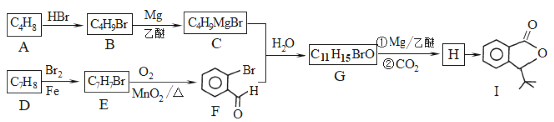
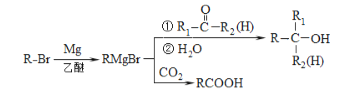
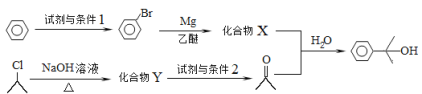
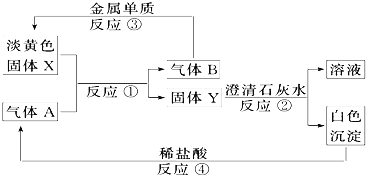
题目内容
【题目】完成下列填空:
(1)28g氮气含有的质子数为____________个。
(2)9.03×1023个H2O分子所含氧原子数与_________gCO2中所含氧原子数相等。
(3)在一定温度和压强下,10mL气体A2跟15mL的气体B2完全化合生成气体A2B3,则该气体在相同条件下的体积为_______________mL。
【答案】14NA 33 10
【解析】
(1)先计算氮气的物质的量,然后根据N2分子中含有14个质子,结合N=nNA计算;
(2)先根据n=![]() 计算H2O的物质的量,然后n(O)=2n(CO2)=n(H2O)计算;
计算H2O的物质的量,然后n(O)=2n(CO2)=n(H2O)计算;
(3)根据体积之比等于物质的量之比,结合原子个数守恒求出气体A2B3的体积;
(1) 28g氮气的物质的量n(N2)=28g÷28g/mol=1mol,由于N2分子中含有14个质子,所以1molN2中含有的质子数目N=1mol×14×NA/mol=14NA;
(2)9.03×1023个H2O分子所含氧原子的物质的量n(O)=n(H2O)=9.03×1023÷6.02×1023/mol=1.5mol,而水分子中含一个氧原子,故水中含有的氧原子的物质的量为1.5mol。由于CO2分子中含有2个O原子,所以当CO2中含有的氧原子也为1.5mol时,CO2的物质的量需为0.75mol,则质量m=nM=0.75mol×44g/mol=33g;
(3)在相同外界条件下,气体的体积之比等于它们的物质的量之比,且在反应过程中原子个数守恒,故10mL气体A2跟15mL的气体B2完全化合生成气体A2B310mL,即反应产生的A2B3气体的体积是10mL。

【题目】如表实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,再通入水中,测所得水溶液的pH | pH<7 | 证明苯与液溴发生的是取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A. AB. BC. CD. D