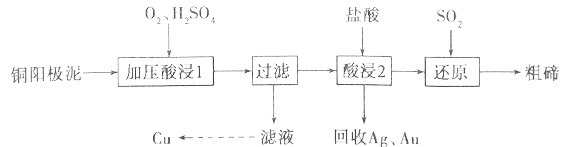
题目内容
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸溶液滴定10.00mL 0.1mol/L的MOH溶液,滴定过程中加入醋酸溶液的体积(V)与溶液中lg[c(H+)/c(OH-)]的关系如图所示(V=0时,lg[c(H+)c(OH-)]=-12)。下列说法不正确的是
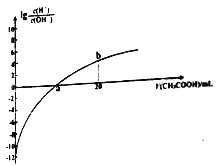
A. MOH是一元强碱
B. a 点:V(CH3COOH)=10.00mL
C. b R:c(M+)>(CH3COOH)>C(H+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数约为5.9×10-10
【答案】B
【解析】
A、由图可知,未加醋酸时,lgc(H+)/c(OH-)=-12,可知c(MOH)=0.1mol·L-1,溶液中c(OH-)=0.1mol·L-1;
B、a点lgc(H+)/c(OH-)=0,溶液为中性;
C、b点溶液中含等量的CH3COOH、CH3COOM,由lgc(H+)/c(OH-)>0可知溶液显酸性;
D、结合Kh=Kw/Ka计算。
A、由图可知,开始时lgc(H+)/c(OH-)=-12,且c(MOH)=0.1mol·L-1,溶液中c(OH-)=0.1mol·L-1,则MOH为强碱,故A正确;
B、a 点对应的lgc(H+)/c(OH-)=0,即c(H+)=c(OH-),溶液呈中性,由于醋酸是弱酸,当与一元强碱等体积等浓度反应时溶液呈弱碱性,所以当溶液呈中性时,醋酸溶液的体积大于10.00 mL,故B错误;
C、b点的溶液中,溶质为等物质的量浓度的醋酸CH3COOH和醋酸盐CH3COOM,由于醋酸电离程度很小,所以溶液中c(H+)<c(M+),正确的关系为c(CH3COO-)>c(M+)>(CH3COOH)>c(H+)>c(OH-),故C正确;
D、25℃时,Ka(CH3COOH)=1.7×10-5,Kw=1.0×10-14,所以CH3COO-的水解平衡常数Kh=1.0×10-14/1.7×10-5=(10/17)×10-9=5.9×10-10,故D正确;
故选B。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率