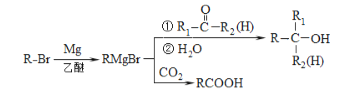
题目内容
【题目】三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子,某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验Ⅰ.探究Na2CS3的性质:
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
③ | 向另一份溶液中滴加用硫酸酸化的KMnO4溶液,紫色褪去 |
(1)H2CS3是___(填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是SO42-,则该反应的离子方程式为:____。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量。你是否同意他的观点,并说明理由:___。
实验Ⅱ.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50.0mLNa2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0mol·L-1的稀H2SO4,关闭活塞。
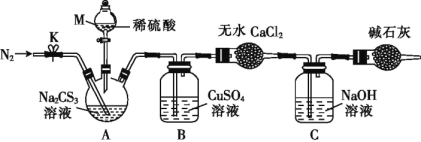
已知:CS32- +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___。反应开始前需要先通入一段时间N2,其作用为____。
(5)B中发生反应的离子方程式为:____。
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___。若B中生成沉淀的质量为8.4g,则Na2CS3溶液的物质的量浓度是____。
【答案】弱 5CS32-+24MnO4-+52H+=15SO42-+5CO2↑+24Mn2++26H2O 不同意,因为步骤③中加入的酸性KMnO4溶液是用H2SO4酸化的,含有SO42-,所以生成的硫酸钡沉淀质量偏大 分液漏斗 排尽装置中的空气,防止生成的H2S被氧化 Cu2++H2S=CuS↓+2H+ 过滤、洗涤、干燥 1.75mol·L-1
【解析】
(1)Na2CS3的水溶液中加入酚酞变红色,说明Na2CS3是强碱弱酸盐;
(2)根据氧化还原反应的规律分析作答;
(3)酸性高锰酸钾溶液用稀硫酸酸化;
(4)根据仪器的图形判断仪器的名称;A中发生Na2CS3+H2SO4=Na2SO4+CS2+H2S↑,生成的硫化氢可与B中的硫酸铜反应生成CuS沉淀;
(5)反应结束后打开活塞k,再缓慢通入热N2一段时间是把生成的硫化氢和二硫化碳全部赶入后面装置完全吸收;
(6)当A中反应完全后,打开K缓慢通入热N2一段时间,然后对B中混合物进行过滤、洗涤、干燥,称重,得8.4黑色固体,根据关系式Na2CS3~H2S~CuS分析计算求得。
(1)Na2CS3的水溶液中加入酚酞变红色,说明Na2CS3是强碱弱酸盐,则H2CS3为弱酸,
故答案为:弱;
(2)步骤③的氧化产物是SO42,还原产物是锰离子,同时还生成二氧化碳、水,离子方程式为5CS32-+24MnO4-+52H+=15SO42-+5CO2↑+24Mn2++26H2O;
(3)酸性高锰酸钾溶液用稀硫酸酸化,所以不能通过计算白色沉淀计算Na2CS3的量,因为步骤③中加入的酸性KMnO4溶液是用H2SO4酸化的,含有SO42-,所以生成的硫酸钡沉淀质量偏大,
故答案为:不同意,因为步骤③中加入的酸性KMnO4溶液是用H2SO4酸化的,含有SO42-,所以生成的硫酸钡沉淀质量偏大;
(4)仪器M的名称为分液漏斗;因H2S为还原性气体,易被空气氧化,故反应开始前需要先通入一段时间N2,排尽装置中的空气,防止生成的H2S被氧化,故答案为:分液漏斗;排尽装置中的空气,防止生成的H2S被氧化;
(5)A中发生Na2CS3+H2SO4=Na2SO4+CS2+H2S↑,生成的硫化氢可与B中的硫酸铜反应生成CuS沉淀,反应的离子方程式为Cu2++H2S=CuS↓+2H+;
(6)当A中反应完全后,打开K缓慢通入热N2一段时间,然后对B中混合物进行过滤、洗涤、干燥,称重,得8.4黑色固体,n(CuS)=![]() ,根据关系式Na2CS3H2SCuS得n(Na2CS3)=n(CuS)=0.0875mol,c(Na2CS3)=
,根据关系式Na2CS3H2SCuS得n(Na2CS3)=n(CuS)=0.0875mol,c(Na2CS3)=![]() = 1.75mol·L-1,
= 1.75mol·L-1,
故答案为:过滤、洗涤、干燥;1.75mol·L-1。

 口算题天天练系列答案
口算题天天练系列答案