题目内容
2.为了有效的控制CO2的排放,工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{加热,加压}$CH3OH(g);△H<0.进行试验时所得实验图象如下则下列描述错误的是( )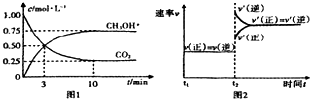
| A. | 平衡时该反应的平衡常数=$\frac{16}{3}(mol/L)^{-2}$ | |
| B. | 平衡时CO2的转化率为50% | |
| C. | t2时刻改变的条件是高温度 | |
| D. | 在0-3min时H2的反应速率为0.5mol•(L•min)-1 |
分析 A、开始时c(CO2)=1mol/L、c(H2)=3mol/L,平衡时c(CO2)=0.25mol/L,c(CH3OH)=c(H2O)=0.75mol/L,则c(H2)=3mol/L-0.75mol/L×3=0.75mol/L,
CO2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{加热,加压}$CH3OH(g)+H2O(g);
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
用化学平衡浓度计算平衡常数,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
B、先根据浓度变化计算平衡时各物质的浓度,转化率=$\frac{消耗量}{起始量}$×100%;
C、反应是放热反应,升高温度反应速率都增大,平衡向吸热反应方向移动;
D、由图可知,3min时甲醇的浓度变化为0.5mol/L,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍为1.5mol/L,结合反应速率v=$\frac{△c}{△t}$计算.
解答 解:A、开始时c(CO2)=1mol/L、c(H2)=3mol/L,平衡时c(CO2)=0.25mol/L,c(CH3OH)=c(H2O)=0.75mol/L,则c(H2)=3mol/L-0.75mol/L×3=0.75mol/L,
CO2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{加热,加压}$CH3OH(g)+H2O(g);
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
K=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$(mol/L)-2,故A正确;
B、平衡时CO2的转化率=$\frac{0.75mol/L}{1mol/L}$×100%=75%,故B错误;
C、根据图象知,改变条件正逆反应速率度增大,且逆反应速率增大的多,平衡逆向进行,逆反应速率大于正反应速率,平衡向逆反应方向移动,正反应是放热反应,说明升高温度符合,故C正确;
D、由图可知,3min时甲醇的浓度变化为0.5mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍=3×0.5mol/L=1.5mol/L,故v(H2)=$\frac{1.5mol/L}{3min}$0.5mol/(L•mon),故D正确;
故选B.
点评 本题考查了化学平衡的有关计算等知识点,根据温度对可逆反应平衡移动方向影响来确定反应热,题目难度中等.

| A. | 单质的熔沸点逐渐降低 | B. | 卤素原子半径逐浙减少 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐减弱 |
| A. | 加入少量W,逆反应速率增大,平衡左移 | |
| B. | 加压,正反应速率增大,逆反应速率减小 | |
| C. | 温度、体积不变,充入He气加压,反应速率加快 | |
| D. | 升温,混合气平均相对分子质量减小 |
| A. | HCOOC2H5 CH3CH2COOH | B. | 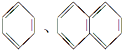 | ||
| C. | O2、O3 | D. | H、D、T |
| A. | 1s22s22p4 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p3 | D. | 1s22s22p63s23p64s2 |
 (1)基态铬原子的价电子排布式为3d54s1.
(1)基态铬原子的价电子排布式为3d54s1.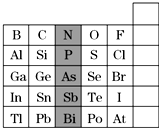 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分: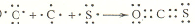 .
.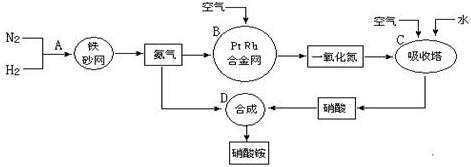
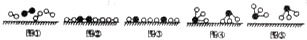
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.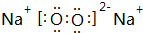 .
. ,空间构型直线型,属于非极性分子(填“极性”或“非极性”)
,空间构型直线型,属于非极性分子(填“极性”或“非极性”)