题目内容
17.某温度下,对可逆反应2X(g)+Y(g)?3Z(g)+W(s)△H>0 的叙述正确的是( )| A. | 加入少量W,逆反应速率增大,平衡左移 | |
| B. | 加压,正反应速率增大,逆反应速率减小 | |
| C. | 温度、体积不变,充入He气加压,反应速率加快 | |
| D. | 升温,混合气平均相对分子质量减小 |
分析 A、固体量的增减不会影响反应速率,不会引起化学平衡的移动;
B、反应是气体体积不变的反应,增大压强反应速率增大;
C、恒温恒压容器中加入 惰性气体,总压增大,分压不变,反应速率不变,平衡不动;
D、升高温度平衡向吸热反应移动,随反应进行,气体的物质的量不变,质量减小分析.
解答 解:对可逆反应2X(g)+Y(g)?3Z(g)+W(s)△H>0 是气体体积不变的吸热反应;
A、固体量的增减不会影响反应速率,加入少量W,不会引起化学平衡的移动,故A错误;
B、反应是气体体积不变的反应,增大压强反应速率增大,正逆 反应速率都增大,故B错误;
C、恒温恒压容器中加入 惰性气体,总压增大,分压不变,反应速率不变,温度、体积不变,充入He气增大压强,反应速率会不变,故C错误;
D、升高温度平衡向吸热反应移动,随反应进行,气体的物质的量不变,质量减小,混合气体的平均相对分子质量减小,故D正确;
故选D.
点评 本题考查平衡移动、外界条件对平衡的影响、平衡状态判断等,难度不大,注意基础知识的掌握.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
7.钢厂酸洗废液(成分如表所示)在工业生产中还具有很多用途.
(1)欲检验该酸洗废液中含有的少量Fe3+,最宜选用的试剂是KSCN溶液;为检验其中的Fe2+,某同学设计了如下实验:取该酸洗废液少许加入试管中,滴入几滴酸性KMnO4溶液后发现紫色消失.该同学得出结论:该溶液中含有Fe2+.大家认为该同学的实验设计不合理,理由是酸性KMnO4溶液会氧化Cl-,导致紫色消失,2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O(用必要的文字和离子方程式解释).
(2)采用石墨作电极电解上述酸洗废液时,初始阶段,阳极板上有气泡生成,此时与该现象有关的阳极电极反应式为2Cl--2e-=Cl2↑;向上述酸洗废液中加入KOH溶液中和后,在合适的电压下电解,可在阳(填“阴”或“阳”)极生成高铁酸钾(K2FeO4).
(3)利用上述酸洗废液、含铝矿石(主要成分为Al2O3、Fe2O3和SiO2)以及新制的硅酸(活化硅酸),制备聚硅酸氯化铝铁絮凝剂(简称PAFSC),具体方法如图1:
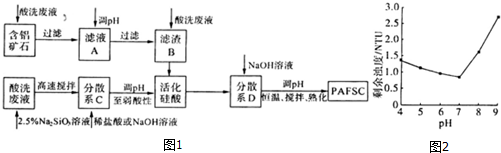
①适当调高滤液A的pH,Al3+和Fe3+转化为沉淀,原因是调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的Qc大于其Ksp;(或调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的沉淀溶解平衡向沉淀方向移动)(请用沉淀溶解平衡的理论解释).
②PAFSC絮凝剂净化水的过程中,Al3+参与反应的离子方程式为Al3++3H2O=Al(OH)3(胶体)+3H+.
③25℃时,PAFSC的除浊效果随溶液pH的变化如图2所示(图中的NTU为浊度单位),则在下列pH范围中,PAFSC除浊效果最佳的是b(填下列序号字母).
a.4~5 b.5~7 c.7~8d.8~9
25℃时,pH>7且随pH增大,PAFSC的除浊效果明显变差,原因是碱性增强,使胶体发生了聚沉现象.
| 成份 | 浓度/(mol•L-1) | 质量分数 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |
(2)采用石墨作电极电解上述酸洗废液时,初始阶段,阳极板上有气泡生成,此时与该现象有关的阳极电极反应式为2Cl--2e-=Cl2↑;向上述酸洗废液中加入KOH溶液中和后,在合适的电压下电解,可在阳(填“阴”或“阳”)极生成高铁酸钾(K2FeO4).
(3)利用上述酸洗废液、含铝矿石(主要成分为Al2O3、Fe2O3和SiO2)以及新制的硅酸(活化硅酸),制备聚硅酸氯化铝铁絮凝剂(简称PAFSC),具体方法如图1:

①适当调高滤液A的pH,Al3+和Fe3+转化为沉淀,原因是调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的Qc大于其Ksp;(或调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的沉淀溶解平衡向沉淀方向移动)(请用沉淀溶解平衡的理论解释).
②PAFSC絮凝剂净化水的过程中,Al3+参与反应的离子方程式为Al3++3H2O=Al(OH)3(胶体)+3H+.
③25℃时,PAFSC的除浊效果随溶液pH的变化如图2所示(图中的NTU为浊度单位),则在下列pH范围中,PAFSC除浊效果最佳的是b(填下列序号字母).
a.4~5 b.5~7 c.7~8d.8~9
25℃时,pH>7且随pH增大,PAFSC的除浊效果明显变差,原因是碱性增强,使胶体发生了聚沉现象.
5.观察下列几个装置示意图,有关叙述正确的是( )
| A. |  装置中阳极上析出红色固体 | |
| B. |  装置的待镀铁制品应与电源负极相连 | |
| C. |  装置中粗铜应与电源负极相连 | |
| D. | 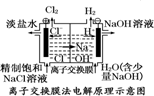 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
2.为了有效的控制CO2的排放,工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{加热,加压}$CH3OH(g);△H<0.进行试验时所得实验图象如下则下列描述错误的是( )
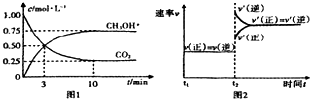

| A. | 平衡时该反应的平衡常数=$\frac{16}{3}(mol/L)^{-2}$ | |
| B. | 平衡时CO2的转化率为50% | |
| C. | t2时刻改变的条件是高温度 | |
| D. | 在0-3min时H2的反应速率为0.5mol•(L•min)-1 |
9.下面关于多电子原子的核外电子的运动规律的叙述正确的是( )
| A. | 核外电子是分层运动的,像卫星一样有确定的轨道 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 能量低的电子在离核近的区域运动 |
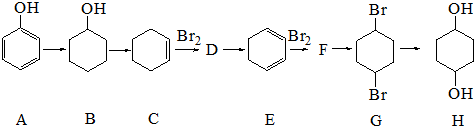
6. A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )
A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )
 A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )
A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )| A. | C→A的反应类型为加成反应 | |
| B. | 若A为2-丙醇,则其可实现如右图的所有转化 | |
| C. | 若A、B、D、为链状化合物,则C也一定为链状化合物 | |
| D. | A的相对分子质量小于C、D的相对分子质量而大于B的相对分子质量 |
7.在元素周期表中,过渡金属区域能找到( )
| A. | 制半导体材料的元素 | B. | 制农药的元素 | ||
| C. | 制催化剂的元素 | D. | 制耐高温合金的元素 |

 +2NaOH$\stackrel{醇△}{→}$
+2NaOH$\stackrel{醇△}{→}$ +2NaBr+2H2O.
+2NaBr+2H2O.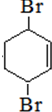 .
. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O. .
.