题目内容
7.工业上制取硝酸铵的流程图如下,请回答下列问题.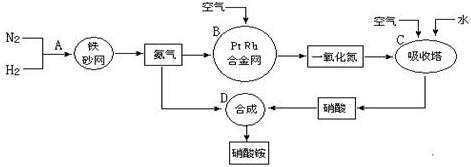
(1)合成氨的工业设备名称是合成塔,设备中设置热交换器的目的是利用余热,节约能源;此生产过程中,N2与H2合成NH3所用的催化剂是铁砂网;生产中原料气必须进行脱硫,目的是防止催化剂中毒.
(2)1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
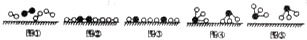
●-●、○-○、
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.(3)吸收塔中反应为4NO+3O2+2H2O=4HNO3;从生产流程看,吸收塔中需要补充空气,其原因是使NO循环利用,全部转化为硝酸.
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下三种方法处理:
方法一:碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O;2NO2+Na2CO3=NaNO2+NaNO3+CO2;
方法二:NH3还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
方法三:甲烷吸收法:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)△H=+867kJ•mol-1(NO也有类似的反应).
上述三种方法中方法一最大的缺点是单独的NO不能被吸收;方法三和方法二相比,优点是甲烷比氨价格便宜,缺点是耗能高.
(5)某化肥厂用NH3制备NH4NO3.已知:由NH3制NO的产率是94%、NO制HNO3的产率是89%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的54.4%.
分析 (1)合成氨的工业设备是合成塔;合成氨的反应属于放热反应;N2与H2合成NH3所用的催化剂是铁砂网;生产中应防止催化剂中毒;
(2)图②中两种双原子分子被吸附在催化剂表面,即N2、H2被吸附在催化剂表面;③中分子中的化学键断裂生成原子,即在催化剂表面N2、H2中的化学键断裂生成N原子和H原子;
(3)在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;
(4)方法一最大的缺点是单独的NO不能被吸收,只能与NO2一起被碱液吸收;方法三和方法二相比,优点是甲烷比氨价格便宜;缺点是方法三的耗能较高;
(5)根据氮原子守恒可知,NH3~NO~HNO3,以此计算.
解答 解:(1)合成氨的工业设备是合成塔;合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器可以充分利用余热,节约能源;N2与H2合成NH3所用的催化剂是铁砂网;生产中原料气必须进行脱硫可以防止催化剂中毒;
故答案为:合成塔;利用余热,节约能源;铁砂网;防止催化剂中毒;
(2)图②中两种双原子分子被吸附在催化剂表面,即N2、H2被吸附在催化剂表面;③中分子中的化学键断裂生成原子,即在催化剂表面N2、H2中的化学键断裂生成N原子和H原子;
故答案为:N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂;
(3)在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸,反应的化学方程式为4NO+3O2+2H2O=4HNO3;
故答案为:4NO+3O2+2H2O=4HNO3;使NO循环利用,全部转化为硝酸;
(4)方法一最大的缺点是单独的NO不能被吸收,只能与NO2一起被碱液吸收;方法三和方法二相比,优点是甲烷比氨价格便宜,节约成本;缺点是方法三的反应热为+867kJ•mol-1,耗能较高;
故答案为:单独的NO不能被吸收;甲烷比氨价格便宜;耗能高;
(5)由NH3制NO的产率是94%、NO制HNO3的产率是89%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×94%×89%=0.8366mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8366mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为 $\frac{1mol}{1mol+0.8366mol}$×100%=54.4%;即制HNO3所用去的NH3的质量占总耗NH3质量的54.4%,
故答案为:54.4.
点评 本题考查了工业制备原理应用,流程分析,实验制备物质的分析判断,利用物质的转化及质量守恒的方法来进行简单计算,使用硝酸铵的注意事项,明确转化中的化学反应得出物质之间的关系是解答的关键,题目难度中等.

| A. | 现需90mL1.0mol/LNaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 | |
| B. | 测定溶液 pH的实验中,用润湿的pH试纸测定新制氯水的pH--测定结果偏高 | |
| C. | 中和热实验测定中,缓慢地将NaOH溶液倒入测定装置中--对测定结果无影响 | |
| D. | 酸碱中和滴定实验中,标准液滴定前无气泡而滴定后有气泡--测定结果偏高 |
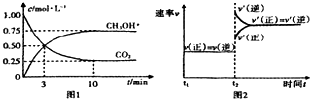
| A. | 平衡时该反应的平衡常数=$\frac{16}{3}(mol/L)^{-2}$ | |
| B. | 平衡时CO2的转化率为50% | |
| C. | t2时刻改变的条件是高温度 | |
| D. | 在0-3min时H2的反应速率为0.5mol•(L•min)-1 |
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为11NA | |
| C. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
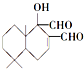 是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基
是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基 .
. .
.