题目内容
【题目】已知某无色溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、AlO2-、CO32-、SO42-、I-、SiO32-,MnO4-中的N种离子组成。某化学兴趣小组通过下列实验确定了其组成:
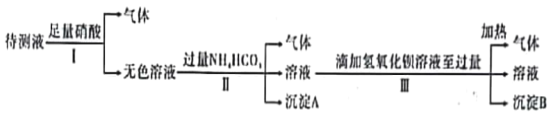
回答下列问题:
(1)不用做实验就可以肯定原溶液X中不存在的离子是_______________(填离子符号)。
(2)通过上述实验知,X溶液中一定存在__________种离子(填数字;不考虑H+、OH-)。
(3)在上述滴加氢氧化钡溶液过程中,开始阶段发生反应的离子方程式一定有_____________
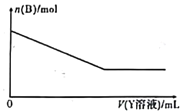
(4)该化学兴趣小组的同学为了进一步确定白色沉淀B的成分,取一定量经洗涤后的B与Y溶液反应,沉淀B的物质的量与Y溶液体积之间的关系如图所示。Y可能为____________。B的组成为__________________
【答案】Cu2+、Fe2+、MnO4- 3 Ba2+ + 2OH- + 2HCO3- = BaCO3↓+ CO32- + 2H2O HNO3(或HCl、HI、HClO4等) BaCO3和BaSO4
【解析】
已知溶液为无色溶液,则不存在有颜色的离子,即可确定没有Cu2+(蓝色)、Fe2+(浅绿色)、MnO4-(紫红色);取适量该溶液,加入足量硝酸,有气体生成,则溶液中一定存在CO32,根据离子共存知,一定不存在与CO32发生反应的Mg2+、Ag+、Ba2+、Al3+离子;同时得到无色溶液,则一定不存在I、SiO32,再根据溶液呈电中性判断原溶液中一定存在唯一阳离子K+;无色溶液中再加入过量NH4HCO3溶液,有气体生成,同时析出沉淀A,说明溶液中一定存在Al3+,原溶液中一定存在AlO2,反应的离子方程式为:Al3+ + 3HCO3- = Al(OH)3↓+3CO2↑,在所得溶液中含有过量的碳酸氢铵,继续滴加氢氧化钡溶液至过量,加热会有氨气生成,沉淀可能为碳酸钡或碳酸钡和硫酸钡的混合物,则X溶液中一定存在CO32、K+、AlO2,据此解答。
(1)已知溶液为无色溶液,则不存在有颜色的离子,即可确定没有Cu2+(蓝色)、Fe2+(浅绿色)、MnO4-(紫红色);
故答案为:Cu2+、Fe2+、MnO4-;
(2)取适量该溶液,加入足量硝酸,有气体生成,则溶液中一定存在CO32,该气体为二氧化碳,根据离子共存知,一定不存在与CO32发生反应的Mg2+、Ag+、Ba2+、Al3+离子;同时得到无色溶液,则一定不存在I、SiO32,再根据溶液呈电中性判断原溶液中一定存在唯一阳离子K+;无色溶液中再加入过量NH4HCO3溶液,有气体生成,同时析出沉淀A,说明溶液中一定存在Al3+,原溶液中一定存在AlO2,反应的离子方程式为:Al3+ + 3HCO3- = Al(OH)3↓+3CO2↑,在所得溶液中含有过量的碳酸氢铵,继续滴加氢氧化钡溶液至过量,加热会有氨气生成,沉淀可能为碳酸钡或碳酸钡和硫酸钡的混合物,则X溶液中一定存在CO32、K+、AlO2,共3种离子;
故答案为:3;
(3)在上述滴加氢氧化钡溶液过程中,开始阶段OH-先与HCO3-反应生成CO32-和H2O,同时生成BaCO3沉淀,此时氢氧化钡的量少,以氢氧化钡为1mol配平该离子方程式,则开始阶段发生反应的离子方程式一定有Ba2+ + 2OH- + 2HCO3- = BaCO3↓+ CO32- + 2H2O;
故答案为:Ba2+ + 2OH- + 2HCO3- = BaCO3↓+ CO32- + 2H2O;
(4)由图像可知沉淀B部分溶于Y溶液,BaCO3溶于HNO3(或HCl、HI、HClO4等),则Y可能为于HNO3(或HCl、HI、HClO4等),则B中一定含有BaCO3、BaSO4;
故答案为:HNO3(或HCl、HI、HClO4等);BaCO3和BaSO4。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】I、如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是______________。
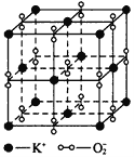
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B.晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3∶1
II、有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如表所示:
项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
B | 3500 | 很大 | 不溶 | 不导电 | 不反应 |
C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体A的化学式为____________________。
(2)晶体B的晶体类型为____________________。
(3)晶体C中粒子间的作用力为____________________。
III、砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池等。
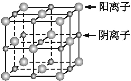
(1)砷化镓的晶胞结构如下图所示,则砷化镓的化学式为____。

(2)基态As原子的核外电子排布式为_________。
(3)第一电离能:Ga____As(填“>”或“<”)。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________。