题目内容
【题目】有以下物质:①石墨;②水银;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧冰酷酸(CH3COOH);⑨氧化钠固体; ⑩液态氯化氢。
(1)其中能导电的是_________; 属于非电解质的是_________; 属于电解质的是____________
(2)等质量④和⑤中氢原子的数目之比为_____; 若④和⑤中所含氢原子数相等, 在相同条件下④和⑤的体积之比为____________
(3)向⑥中加入少量⑦请写出离子方程式:____________________________________
【答案】①②⑦ ③④ ⑤⑥⑧⑨⑩ 3:1 2:3 2HCO3-+Ba2+ +2OH-=BaCO3↓+CO32-+2H2O
【解析】
(1)能导电的物质必须具有能自由移动的带电的微粒,金属能导电是由于金属中存在能自由移动的带负电的电子;非电解质是指:在熔融状态和水溶液中都不能导电的化合物;单质,混合物既不是电解质也不是非电解质;强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐;
(2)结合n=![]() =
=![]() =
=![]() 计算;
计算;
(3) 碳酸氢钠固体中加入少量氢氧化钡溶液生成碳酸钡沉淀和碳酸钠。
(1)①石墨和②水银均能导电,是单质,不是电解质,也不是非电解质;
③酒精和④氨气均不导电,是非电解质;
⑤硫化氢和⑥碳酸氢钠固体均不导电,是电解质;
⑦氢氧化钡溶液能导电,是混合物,不是电解质,也不是非电解质;
⑧冰酷酸(CH3COOH)、⑨氧化钠固体、⑩液态氯化氢均不导电,是电解质;
则其中能导电的是①、②和⑦;属于非电解质的是③④;属于电解质的是⑤⑥⑧⑨⑩;
(2)由n=![]() 可知等质量氨气和硫化氢的物质的量之比与摩尔质量成反比,即n(NH3):n(H2S)=34g/mol:17g/mol=2:1,则等质量氨气和硫化氢的中氢原子的数目之比为(2×3):(1×2)=3:1;若氨气和硫化氢的中氢原子数相等,则n(NH3):n(H2S)=
可知等质量氨气和硫化氢的物质的量之比与摩尔质量成反比,即n(NH3):n(H2S)=34g/mol:17g/mol=2:1,则等质量氨气和硫化氢的中氢原子的数目之比为(2×3):(1×2)=3:1;若氨气和硫化氢的中氢原子数相等,则n(NH3):n(H2S)=![]() :
:![]() =2:3,由n=
=2:3,由n=![]() 可知在相同条件下氨气和硫化氢的体积之比为2:3;
可知在相同条件下氨气和硫化氢的体积之比为2:3;
(3) 碳酸氢钠固体中加入少量氢氧化钡溶液生成碳酸钡沉淀和碳酸钠,发生反应的离子方程式为2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O。

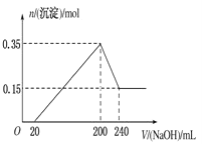
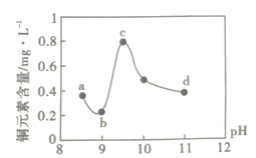
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:Cu(OH)2+4NH3![]() [Cu(NH3)4]2+2OH-
[Cu(NH3)4]2+2OH-
平衡Ⅱ:Cu(OH)2+2OH-![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mg·L-1 | 72 | ≤0.5 |
Nh4+/mg·L-1 | 2632 | ≤15 |
下列说法错误的是( )
A.a~b段发生的反应为:Cu2++2OH-=Cu(OH)2↓
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
【题目】下列实验“操作和现象”与“实验目的、结论”的对应关系中正确的是( )
操作和现象 | 实验目的或结论 | |
A | 将H2S气体通入CuSO4溶液中,产生黑色沉淀 | H2S的酸性比H2SO4的强 |
B | 固体溶解于水后的溶液中加入澄清的石灰水 | 探究家庭“食用碱”的成分是 碳酸钠还是碳酸氢钠 |
C | 某溶液先加稀硝酸,再加BaCl2溶液,产生白色沉淀 | 能证明该溶液中一定含有Ag+ |
D | 向MgCl2溶液(含FeCl3)中加入足量MgCO3粉末 | 除去MgCl2溶液中少量FeCl3 |
A. AB. BC. CD. D