题目内容
【题目】下列说法错误的是( )
A. ![]() σ键和π键比例为7:1
σ键和π键比例为7:1
B. 某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C. C22﹣与O22+互为等电子体,1 mol O22+中含有的π键数目为2NA, O22+的电子式可表示为 ![]()
D. 已知反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l),若该反应中有4 mol N﹣H键断裂,则形成的π键数目为3NA
【答案】A
【解析】
A.单键全是σ键,双键中1个是σ键、一个是π键, ![]() 中σ键和π键比例为9:1,故A错误;
中σ键和π键比例为9:1,故A错误;
B. 某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,第三电离能突然增大,所以最外层有2个电子,当它与氯气反应时可能生成的阳离子是X2+,故B正确;
C. 等电子体结构相似,C22﹣与O22+互为等电子体,O22+的电子式可表示为 ![]() ,所以1 mol O22+中含有的π键数目为2NA,故C正确;
,所以1 mol O22+中含有的π键数目为2NA,故C正确;
D. 已知反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l),若该反应中有4 mol N﹣H键断裂,则生成1.5mol氮气,形成的π键数目为3NA,故D正确。

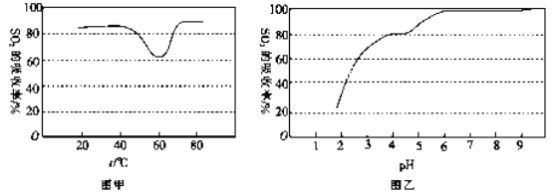
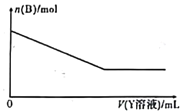
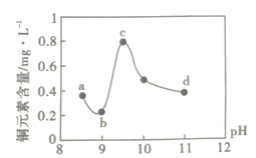
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:Cu(OH)2+4NH3![]() [Cu(NH3)4]2+2OH-
[Cu(NH3)4]2+2OH-
平衡Ⅱ:Cu(OH)2+2OH-![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mg·L-1 | 72 | ≤0.5 |
Nh4+/mg·L-1 | 2632 | ≤15 |
下列说法错误的是( )
A.a~b段发生的反应为:Cu2++2OH-=Cu(OH)2↓
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
【题目】下列实验“操作和现象”与“实验目的、结论”的对应关系中正确的是( )
操作和现象 | 实验目的或结论 | |
A | 将H2S气体通入CuSO4溶液中,产生黑色沉淀 | H2S的酸性比H2SO4的强 |
B | 固体溶解于水后的溶液中加入澄清的石灰水 | 探究家庭“食用碱”的成分是 碳酸钠还是碳酸氢钠 |
C | 某溶液先加稀硝酸,再加BaCl2溶液,产生白色沉淀 | 能证明该溶液中一定含有Ag+ |
D | 向MgCl2溶液(含FeCl3)中加入足量MgCO3粉末 | 除去MgCl2溶液中少量FeCl3 |
A. AB. BC. CD. D