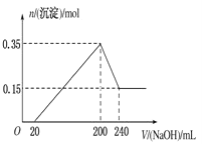
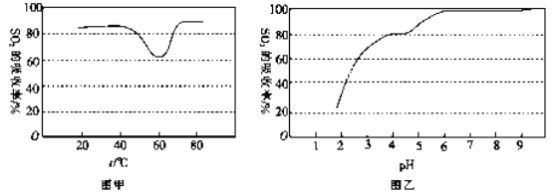
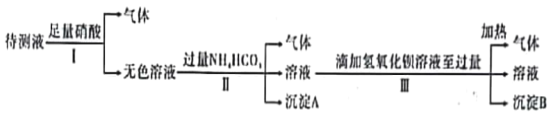
题目内容
【题目】已知某离子晶体的晶胞示意图如下图所示,其摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,晶体的密度为d g·cm-3。
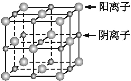
下列说法中正确的是
A. 晶体晶胞中阴、阳离子的个数都为1
B. 晶体中阴、阳离子的配位数都是4
C. 该晶胞可能是NaCl的晶胞
D. 该晶体中两个距离最近的阳离子的核间距为M/d cm
【答案】C
【解析】
A、用均摊法分析,晶体晶胞中阴、阳离子的个数都为4,故A项错误。
B、阴、阳离子的配位数都是6,故B项错误。
C、该晶胞符合NaCl晶胞的特征,故C项正确。
D、根据氯化钠的晶胞结构图进行计算:设晶胞边长为a cm,则两个距离最近的阳离子的核间距离为a cm,4×M=NA·a3·d,可求出a,进而求得核间距,故D项错误。
综上所述,本题应选C。

 名校课堂系列答案
名校课堂系列答案【题目】T℃时,向1.0L恒容密闭容器中充入1.0mol SO3气体,发生反应:2SO3(g)![]() 2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
条件改变 | 结论 | |
A | 平衡后的容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
B | 起始时向容器中充入1.0molSO2 和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
C | 起始时向容器中充入2.0 molSO3、0.50 molSO2和0.25 mol O2 | 反应达到平衡前v(正)>v(逆) |
D | 起始向容器中充入2.5 molSO2 和1.25molO2 | 达到平衡时,SO2的转化率为80.0% |
A. AB. BC. CD. D
【题目】已知几种化学键的键能和热化学方程式如下:
化学键 | H—N | N—N | Cl—Cl | N | H—Cl |
键能/(kJ·mol-1) | 391 | 193 | 243 | 946 | 432 |
N2H4(g)+2Cl2(g)=N2(g)+4HCl(g) ΔH,下列推断正确的是( )
A.H(g)+Cl(g)=HCl(g) ΔH=+432kJ·mol-1
B.断裂1molCl—Cl键吸收能量比断裂1molN![]() N键多703kJ
N键多703kJ
C.上述反应中,ΔH=-431kJ·mol-1
D.上述反应中,断裂极性键和非极性键,只形成极性键