题目内容
【题目】油画所用的颜料有许多天然矿石成分,矿石中往往含有B、C、O、Na、P、Cl等元素,它们在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+中碳原子的杂化方式为_________,CH3-的空间构型为_______。
(3) Na+和Ne互为等电子体,电离能I2(Na)______I1(Ne)(填“>”或“<”)。
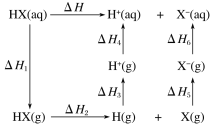
(4)氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为__________,从原子结构分析影响ΔH2递变的因素为__________。
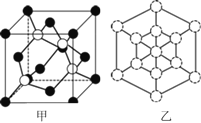
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子。已知晶胞中最近的B、P原子的距离为apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。(列出计算式即可,不必化简)
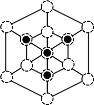
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置____。
画出B原子的投影位置____。
【答案】原子光谱 sp2 三角锥形 > HF的水溶液中存在氢键 原子半径 ![]()
 或
或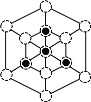
【解析】
(1)光谱分析中利用原子光谱上的特征谱线来鉴定元素;
(2)CH3+中的碳原子形成3个σ键,没有孤对电子,杂化轨道数目为3;CH3-与NH3、H3O+互为等电子体,空间结构相似,据此分析解答;
(3)钠离子的正电性较强对核外电子的吸引力比氖更强,据此进行分析;
(4)HF分子间,以及HF与水分子间均能形成氢键,而其他卤化氢没有,故从溶液中分离出HF分子需要更多的能量;根据HF、HCl、HBr、HI中存在的卤素原子不同,结合原子结构的知识分析解答;
(5)①利用均摊法计算晶胞或者P、B原子数目,晶胞中最近的B、P原子的距离为晶胞体对角线的![]() ,据此计算晶胞的密度;②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B或者3个P形成,据此作图。
,据此计算晶胞的密度;②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B或者3个P形成,据此作图。
(1)光谱分析中利用原子光谱上的特征谱线来鉴定元素,所以在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,故答案为:原子光谱;
(2)CH3+中的碳原子形成3个σ键,没有孤对电子,杂化轨道数目为3,碳原子采取sp2杂化;CH3-与NH3、H3O+均具有8个价电子、4个原子,互为等电子体,几何构型均为三角锥形,故答案为:sp2杂化;三角锥形;
(3)钠离子的正电性较强且半径较小,对核外电子的吸引力比氖原子更强,要想失去电子需要更多的能量,因此钠的第二电离能比氖的第一电离能更高,故答案为:>;
(4)HF分子与水分子、HF分子之间均存在氢键,而其他卤化氢没有,故从溶液中分离出HF分子需要更多的能量,导致ΔH1(HF)特别大;键能大小关系为:HF>HCl>HBr>HI,从原子结构方面分析,影响△H2递变的因素为卤素原子的原子半径的大小,故答案为:HF的水溶液中存在氢键;原子半径;
(5)①实心球为磷原子,处于晶胞顶点与面心,P做面心立方最密堆积;1个晶胞中,含有P原子数目为8×![]() +6×
+6×![]() =4个,含有B原子数目为4个,晶胞质量=
=4个,含有B原子数目为4个,晶胞质量=![]() g,设晶胞的棱长为x,已知晶胞中最近的B、P原子的距离为a pm,该距离为晶胞体对角线的
g,设晶胞的棱长为x,已知晶胞中最近的B、P原子的距离为a pm,该距离为晶胞体对角线的![]() ,则
,则![]() x=a pm= a×1010 cm,x=
x=a pm= a×1010 cm,x=![]() ×a×1010cm,晶体密度ρ=
×a×1010cm,晶体密度ρ=![]() =
= =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() ;
;
②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B或者3个P形成,所以画图为: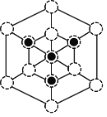 或
或 ,故答案为:
,故答案为: 或
或 。
。