题目内容
(12分) A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式 。
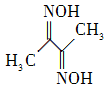
(2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。
(3)化合物E3C与水反应的原理和氮化镁与水反应的原理相同,写出E3C与盐酸反应的化学方程式 。
(4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子
① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式 。
② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+时,反应中电子转移为4 mol,写出该反应的离子方程式_______________。
(1)HNO3、NH4NO3(2)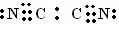 ;(3)Na3N + 4HCl = 3NaCl+NH4Cl
;(3)Na3N + 4HCl = 3NaCl+NH4Cl
(4)① C2H6(g)+7/2 O2(g) = 2CO2 (g) + 3H2O;△H = 一1559 kJ / mol
或 2C2H6(g)+7 O2(g) = 4CO2 (g) + 6H2O (l) ;△H = 一3118 kJ / mol
② 2 Fe2+ + 6 I- + 4 H2O2 + 8 H+ =" 2" Fe3+ + 3 I2 + 8 H2O
解析试题分析:根据题意可推知这几种元素分别是:A是H;B是C;C是N;D是O;E是Na。(1)由H、N、O三种元素可组成多种化合物,其中常见化合物的化学式是HNO2、HNO3、NH4NO3等。(2)在N和C组成化合物 (NC)2则(NC)2的电子式是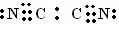 ;(3)Na3N与盐酸反应的化学方程式是Na3N + 4HCl = 3NaCl+NH4Cl;(4)根据题意可知:甲是C2H6;乙是H2O2。①结合已知条件可得乙烷燃烧的热化学方程式是:C2H6(g)+7/2 O2(g) = 2CO2 (g) + 3H2O;△H = 一1559 kJ / mol或2C2H6(g)+7 O2(g) = 4CO2 (g) + 6H2O (l) ;△H = 一3118 kJ / mol;②Fe2+ 和 6 I-都有还原性,而H2O2有氧化性,在酸性条件下二者发生氧化还原反应。根据质量守恒定律和电子守恒、电荷守恒的知识可得其离子方程式是:2 Fe2+ + 6 I- + 4 H2O2 + 8 H+ =" 2" Fe3+ + 3 I2 + 8 H2O。
;(3)Na3N与盐酸反应的化学方程式是Na3N + 4HCl = 3NaCl+NH4Cl;(4)根据题意可知:甲是C2H6;乙是H2O2。①结合已知条件可得乙烷燃烧的热化学方程式是:C2H6(g)+7/2 O2(g) = 2CO2 (g) + 3H2O;△H = 一1559 kJ / mol或2C2H6(g)+7 O2(g) = 4CO2 (g) + 6H2O (l) ;△H = 一3118 kJ / mol;②Fe2+ 和 6 I-都有还原性,而H2O2有氧化性,在酸性条件下二者发生氧化还原反应。根据质量守恒定律和电子守恒、电荷守恒的知识可得其离子方程式是:2 Fe2+ + 6 I- + 4 H2O2 + 8 H+ =" 2" Fe3+ + 3 I2 + 8 H2O。
考点:考查元素集化合物的推断、化学式、电子式、化学方程式、离子方程式及燃烧的热化学方程式的书写的知识。

(8分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a | | | |||||
| | | | b | c | d | | |
| e | | f | | | g | | |
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_____________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
【选修3-物质结构与性质】(20分)
19-I(6分)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是
| A.SiX4难水解 | B.SiX4是共价化合物 |
| C.NaX易水解 | D.NaX的熔点一般高于SiX4 |
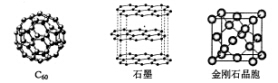
回答下列问题:
(1)金刚石、石墨、C60.碳纳米管等都是碳元素的单质形式,它们互为_____________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为____、____。
(3)C60属于____晶体,石墨属于____晶体。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的____共价键,而石墨层内的C-C间不仅存在____共价键,还有____键。
(5)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(不要求计算结果)。
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(2)元素Y与元素Z相比,金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
e.Y失去电子的数目比Z少
(3)T、X、Y、Z中有两种元素能形成一种淡黄色的固体,写出该化合物的电子式 ,该物质中含有的化学键是 。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时密度等于氧气,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式 。
(5) X与Z形成的化合物ZX结构类似金刚石,最高可稳定到2200℃,推测属于
晶体。打开盛有ZX的袋口可闻到氨气味,故应避水保存,写出变质反应的化学方程式
。
(15分) 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是 ,B、C、D的电负性由小到大的顺序为
__ (用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是 。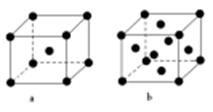
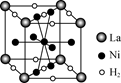
(2)E原子的基态电子排布式为 。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为 。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。

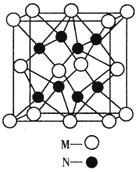
 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为