题目内容
(15分) 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是 ,B、C、D的电负性由小到大的顺序为
__ (用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是 。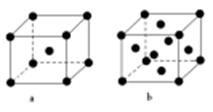
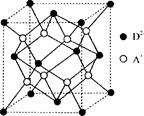
(2)E原子的基态电子排布式为 。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为 。
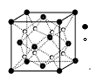
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(15分)
(1)sp3(2分)Na<Cl<F (2分) HF和H2O分子之间能形成氢键(3分)
(2)1S22S22P63S23d104S1或〔Ar〕3d104S1(2分) 2∶1 (2分)
(3)TiN>MgO>CaO>KCl (2分)
(4)CrO2 (2分)
解析试题分析:A、B、C、D、E都是元素周期表中的前四周期元素,A原子的p轨道半充满,外围电子排布为nS2nP3,处于ⅤA族,形成的氢化物的沸点是同主族非金属元素氢化物中最高的,则A为N元素;D原子得到一个电子后3p轨道全充满,原子的电子排布式应为1S22S22P63S23P5,为Cl元素;B+比D原子形成的离子少一个电子层,则B应为Na元素;C与B形成BC型离子化合物,则C应为第Ⅶ主族元素,根据原子序数A<C<B<D<E可知C为F元素;E的原子序数为29,为Cu元素。
(1)元素A简单氢化物是NH3, N原子形成3个σ键,还有1对孤对电子,所以其杂化方式为)sp3;根据同周期随原子序数递增电负性增大,同主族自上而下电负性减小,可得电负性顺序为:Na<Cl<F;F原子半径小而电负性大,所以HF和H2O分子之间能形成氢键,因此HF易溶于水。
(2)根据能量最低原理书写核外电子排布式为:1S22S22P63S23d104S1或〔Ar〕3d104S1;用均摊法计算图a和b中的Cu原子,面心立方堆积的晶胞含Cu原子数目:8×1/8+6×1/2=4,体心立方堆积的晶胞含Cu原子数目:8×1/8+1=2,所以面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1。
(3)晶格能越大熔点越高,所以4种离子晶体熔点从高到低的顺序是:TiN>MgO>CaO>KCl
(4)V2O5中V 没有未成对电子,CrO2中Cr含有2个未成对电子,所以适合作录音带磁粉原料的是CrO2。
考点:本题考查元素的推断、杂化方式、电负性、氢键、晶胞的计算、熔点的比较、未成对电子的判断。

碱金属元素在科学研究与生产生活中有着非常广泛的用途。
(1)锂是最轻的金属,如果用锂做一架飞机,两个人就可以抬动。锂在元素周期表中的表示如图所示,填写以下空格。
①Li在元素周期表中的位置: 。
②6.941的意义: __________________________。
(2)光电管是利用碱金属铯受到光照射时能形成电流这一光电效应的性质制成的。
①完成铯的原子结构示意图: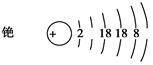
②下列有关铯的说法正确的是________。
| A.其单质在常温下与水反应不如钠剧烈, | B.其原子半径比钾原子半径小 |
| C.其氢氧化物的水溶液不能使氢氧化铝溶解, | D.其碳酸盐易溶于水 |
(本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有 种不同能量的电子,这些电子分占 种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
25.NaOH在实验室中常用来进行洗气和提纯,当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________________________。
26.金属铝与一般的金属比较,在化学性质上表现出的三大特性为:
。
27.晶体硅、金刚石和金刚砂(SiC)硬度由大到小的顺序是 。
28.钙沸石CaAl2Si3O10·3H2O改写成氧化物的形式为 。