题目内容
(15分)
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素Q的名称为__________,P的基态原子价层电子排布式为__________ 。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________________________.
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
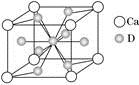
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________ ,其中M离子的配位数为__________,该晶体类型为___________。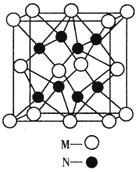
(5)该晶胞的边长为a×10 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为
__________cm。
(1)锰(1分) 3d54s1(2分)
(2)HF分子间存在氢键,而HCl分子间无氢键(2分)
(3)O>Cl(1分) 正四面体形(1分) sp3杂化(1分)
(4)Na2O(2分) 8(1分) 离子晶体(1分)
(5)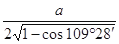 ×10-10或
×10-10或 ×10-10或
×10-10或 ×10-10(3分,或其他合理答案)
×10-10(3分,或其他合理答案)
解析试题分析:依题意可知:M为氧元素,N为钠元素,O是氯元素,P是铬元素,Q是锰元素,因此有:
(1)元素Q的名称为锰,P的基态原子价层电子排布式为3d54s1;
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低是因为HF分子间存在氢键,而HCl分子间无氢键
(3)M、O电负性大小顺序是O>Cl,O的最高价含氧酸根为ClO4-,空间构型为正四面体。空间构型其中心原子的杂化类型为sp3杂化
(4)M微粒的数目为: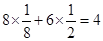 ;N微粒的数目为:8;因此M、N形成的化合物的晶胞的化学式为Na2O;其中M离子的配位数为8,该晶体类型为离子晶体。
;N微粒的数目为:8;因此M、N形成的化合物的晶胞的化学式为Na2O;其中M离子的配位数为8,该晶体类型为离子晶体。
(5)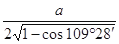 ×10-10或
×10-10或 ×10-10或
×10-10或 ×10-10
×10-10
考点:考查物质结构。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案(本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有 种不同能量的电子,这些电子分占 种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
25.NaOH在实验室中常用来进行洗气和提纯,当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________________________。
26.金属铝与一般的金属比较,在化学性质上表现出的三大特性为:
。
27.晶体硅、金刚石和金刚砂(SiC)硬度由大到小的顺序是 。
28.钙沸石CaAl2Si3O10·3H2O改写成氧化物的形式为 。
(8分)下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
请按要求回答下列问题:
⑴ 画出元素②的原子结构示意图 。
⑵ 属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
⑶③、⑦两种元素相比较,非金属性强的是 (填元素符号)。
⑷ 元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是 , 。
⑸ 元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式: 。
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W在元素周期表中的位置为 ;X、Y、Z、W四种元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为 ;B的电子式为 。化合物ZY中存在的化学键类型为 。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为 ,其最高价氧化物对应的水化物的化学式为 。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是 (用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为 。检验溶液中R3+常用的试剂是 ,可以观察到的现象是 。
(5)Z
 W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。 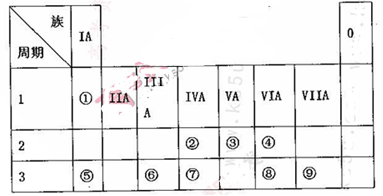


 (3)1 mol AB-中含有的π键个数为________。
(3)1 mol AB-中含有的π键个数为________。