题目内容
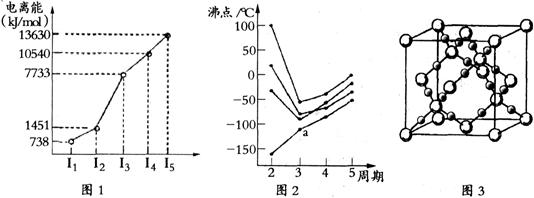
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(2)元素Y与元素Z相比,金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
e.Y失去电子的数目比Z少
(3)T、X、Y、Z中有两种元素能形成一种淡黄色的固体,写出该化合物的电子式 ,该物质中含有的化学键是 。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时密度等于氧气,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式 。
(5) X与Z形成的化合物ZX结构类似金刚石,最高可稳定到2200℃,推测属于
晶体。打开盛有ZX的袋口可闻到氨气味,故应避水保存,写出变质反应的化学方程式
。
((1)、(2)以及(5)中的原子1分一格,其余每空2分)
(1)第2周期ⅥA族(2)Na ; c、d (3)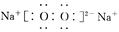 离子键、共价键;
离子键、共价键;
(4)N2H4+2H2O2 N2↑+4H2O (5)原子;AlN+3H2O=Al(OH)3↓+NH3↑
N2↑+4H2O (5)原子;AlN+3H2O=Al(OH)3↓+NH3↑
解析试题分析:T的最外层电子数是次外层电子数的3倍,次外层电子数为2,最外层电子数为6,所以T为O;X的常温下单质为双原子分子,分子中含有3对共用电子对,则X为N;Y的M层比K层少1个电子,所以质子数为11,即Y为Na;Z的第3周期元素的简单离子中半径最小,所以Z为Al,然后结合元素及其单质、化合物的性质、结构来解答。
考点:考查了原子结构、元素周期律、元素周期表、化学键、晶体类型、化学方程式的书写等知识。

练习册系列答案
相关题目
(本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有 种不同能量的电子,这些电子分占 种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
25.NaOH在实验室中常用来进行洗气和提纯,当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________________________。
26.金属铝与一般的金属比较,在化学性质上表现出的三大特性为:
。
27.晶体硅、金刚石和金刚砂(SiC)硬度由大到小的顺序是 。
28.钙沸石CaAl2Si3O10·3H2O改写成氧化物的形式为 。
(8分)下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
请按要求回答下列问题:
⑴ 画出元素②的原子结构示意图 。
⑵ 属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
⑶③、⑦两种元素相比较,非金属性强的是 (填元素符号)。
⑷ 元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是 , 。
⑸ 元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式: 。