题目内容
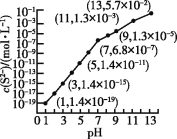
【题目】25 ℃时,向0.10 mol·L-1 H2S溶液中通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)的关系如图(忽略溶液体积的变化、H2S的挥发)。已知H2S的Ka1=1.3×10-7,Ka2=7.1×10-15,CdS的Ksp=3.6×10-29,一般认为溶液中离子浓度不大于1.0×10-5 mol·L-1时即沉淀完全。下列说法正确的是
A. pH=13时,溶液中的溶质为Na2S
B. pH=5时,向H2S溶液中通入了少量的HCl
C. pH=7时,溶液中c(H2S)≈0.043 mol·L-1
D. pH=1时,c(S2-)太小,故不能处理含Cd2+的污水
【答案】C
【解析】
A、根据题图的信息,pH=13时,c(S2-)=5.7×10-2 mol·L-1,若溶质为Na2S,则根据S元素守恒,c(S2-)应接近0.10 mol·L-1,A错误;
B、0.10 mol·L-1 H2S溶液中,电离平衡常数的公式Ka1=![]() =1.3×10-7,由于溶液中c(HS-)与c(H+)近似相等,则c(H+)≈10-4 mol·L-1,即0.10 mol·L-1 H2S溶液的pH约为4;若向H2S溶液中通入了少量的HCl,c(H+)会增大,pH<4,B错误;
=1.3×10-7,由于溶液中c(HS-)与c(H+)近似相等,则c(H+)≈10-4 mol·L-1,即0.10 mol·L-1 H2S溶液的pH约为4;若向H2S溶液中通入了少量的HCl,c(H+)会增大,pH<4,B错误;
C、根据溶液中的S元素守恒,可以得出c(H2S)+c(HS-)+c(S2-)=0.10 mol·L-1,pH=7时,c(S2-)=6.8×10-7 mol·L-1,则c(H2S)+c(HS-)+6.8×10-7 mol·L-1=0.10 mol·L-1①,又由Ka1=![]() =1.3×10-7,可以推出
=1.3×10-7,可以推出![]() ②,将②式代入①式,可算出c(H2S)≈0.043 mol·L-1,C正确;
②,将②式代入①式,可算出c(H2S)≈0.043 mol·L-1,C正确;
D、pH=1时,c(S2-)=1.4×10-19 mol·L-1,根据Ksp=c(Cd2+)·c(S2-)=3.6×10-29,算出c(Cd2+)=2.57×10-10 mol·L-1<1.0×10-5 mol·L-1,故可以处理含Cd2+的污水,D错误。
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案