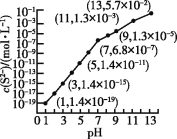
题目内容
【题目】设NA为阿伏加德罗常数。下列说法中正确的是( )
A. 1molCl2与1molCH4恰好完全反应,则转移的电子总数为2NA
B. 15g甲基(—CH3)所含电子数为10NA
C. 2.8g ![]() 中含有的碳原子数为0.2n NA
中含有的碳原子数为0.2n NA
D. 标准状况下,2.24LCHCl3含有的分子数为0.1NA
【答案】A
【解析】
A.1molCl2与1molCH4恰好完全反应,氯气做氧化剂得到电子,甲烷做还原剂失电子,则转移的电子总数为2NA,故A正确;
B.15g甲基的物质的量为1mol,含有9mol电子,所含的电子数为9NA,故B错误;
C.2.8g![]() 中含有的碳原子数=2.8g÷28ng/mol×2n×NA=0.2NA,故C错误;
中含有的碳原子数=2.8g÷28ng/mol×2n×NA=0.2NA,故C错误;
D.标准状况下,CHCl3是液体,所以不能用气体摩尔体积进行求算,故D错误。
故选A。

练习册系列答案
相关题目
【题目】(一)Na、Cu、O、Si、S、Cl是常见的六种元素.
(1)Na位于元素周期表第__周期第__族;S的基态原子核外有__个未成对电子;
Si的基态原子核外电子排布式为__.
(2)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
Si______S | O2-______Na+ | NaCl ______ Si | H2SO4 __________HClO4 |
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取.写出该反应的离子方程式,并标出电子转移的方向和数目___
(二).某元素的原子序数为33,请回答:
(1)该元素原子核外有_______个电子层,______个能级,______个原子轨道。
(2)它的最外层电子排布式为____________,它的电子排布式为________,轨道表示式为_______________。