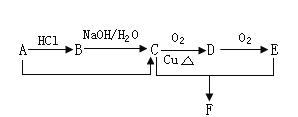
题目内容
【题目】用NA表示阿伏加德罗常数的值,下列关于0.2 mol·L1 K2SO4溶液的说法正确的是
A. 1 L溶液中K+浓度是0.4 mol·L1
B. 500 mL溶液中含有0.1NA个K+
C. 1 L溶液中所含K+、![]() 总数为0.3NA
总数为0.3NA
D. 2 L溶液中![]() 浓度是0.4 mol·L1
浓度是0.4 mol·L1
【答案】A
【解析】
离子个数值之比等于离子的物质的量之比等于溶液中离子的物质的量浓度之比。
A. c(K2SO4)=0.2 mol·L1,故c(K+)=0.4 mol·L1,K+的浓度与所取溶液体积无关,故A正确。
B. 500 mL溶液中n(K+)=0.4 mol·L1×0.5 L=0.2 mol,即0.2NA,故B错误。
C. 1L溶液 c(SO42-)=0.2 mol·L1,n(SO42-)=0.2 mol·L1×1 L=0.2 mol;n(K+)=0.4 mol·L1×1 L=0.4 mol,所以K+、SO42-总物质的量为0.6 mol,故C错误。
D. c(K2SO4)=0.2 mol·L1,故c(SO42-)=0.2 mol·L1,SO42-的浓度与所取溶液体积无关,故D错误。
所以答案选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目