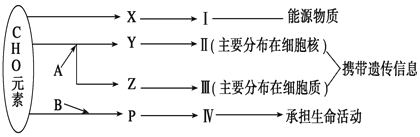
题目内容
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
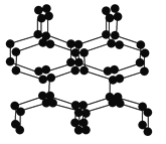
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
【答案】C
【解析】
A.高聚氮中含N-N键,则该晶体中含有非极性共价键,故A正确;B.含N5+离子的化合物,为离子化合物,还存在N-N键,则含N5+离子的化合物中既有离子键又有共价键,故B正确;C.同素异形体的分析对象为单质,而N5+为离子,与单质不能互为同素异形体,故C错误;D.N-N易断裂,高聚氮能量较高,则固体的可能潜在应用是烈性炸药或高能材料,故D正确;故选C。

练习册系列答案
相关题目