题目内容
【题目】托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础。
(1)其中标示出使用温度的仪器是________________。
(2)下列操作中,容量瓶所不具备的功能有________________ (填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的溶液 D.准确稀释某一浓度的溶液
E.量取一定体积的液体 F.用来加热溶解固体溶质
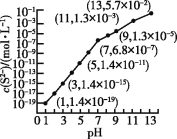
(3)如图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数。其中为量筒的是________________ (填编号,),读数为_____mL。

(4)实验室用98%的浓硫酸配制(浓硫酸的密1.84g/mL)450mL 0.1 mol·L-1的硫酸。回答下列问题
① 配制中应选用的玻璃仪器有_________________,应量取________mL 98%的浓硫酸。
② 量筒在使用前已洗干净但不干燥,对结果是否造成影响________(填“是”或“否”),某同学认为将量筒内的浓硫酸倒出之后,应将量筒洗涤—下并将洗涤液倒入烧杯中,最后转移到容量瓶中,你认为他的做法______(填“对”或“错”)。
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于 0.1mol/L有 ______(填序号)
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面
【答案】容量瓶、量筒 BCDEF ② 2.5(或2.6) 量筒、胶头滴管、500ml容量瓶、烧杯、玻璃棒 2.7 是 错 AD
【解析】
(1)液体的体积受温度的影响较大,使用时应在规定的温度下测出的体积才准确;
(2)容量瓶作为精密仪器,是用来配制一定物质的量浓度的溶液的主要仪器,不可用于贮存和溶解、稀释物质,也不能测量除其规格以外容积的液体体积;
(3)量筒无“0”刻度,且刻度下面小,上面大,精确到0.1mL;
(4)①用浓硫酸配制稀硫酸的实验步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,根据该实验步骤确定所需仪器;根据稀释定律:稀释前后溶质物质的量不变,计算所需浓硫酸的体积;
②量筒在使用前已洗干净但不干燥,量取硫酸的浓度偏低;使用量筒量取一定体积的液体时,不需要洗涤;
③根据公式![]() ,判断不当操作对于溶质物质的量、溶液体积的影响,从而判断对浓度的影响。
,判断不当操作对于溶质物质的量、溶液体积的影响,从而判断对浓度的影响。
(1)液体的体积受温度的影响较大,使用时应在规定的温度下测出的体积才准确,量筒、容量瓶中的液体的温度不同,导致体积产生误差;
故答案为:容量瓶、量筒;
(2)容量瓶作为精密仪器,是用来配制一定物质的量浓度的溶液的主要仪器,不可用于贮存和溶解、稀释物质,也不能测量除其规格以外容积的液体体积,所以容量瓶不具备的功能有:BCDEF;
故答案为:BCDEF;
(3)量筒无“0”刻度,且刻度下面小,上面大,从图中给出仪器的刻度特点,可知②为量筒,读数为2.5(或2.6)mL;
故答案为:②;2.5(或2.6);
(4)①配制450mL硫酸应选用500mL容量瓶,用浓硫酸配制稀硫酸的实验步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,结合实验步骤,可知配制中应选用的玻璃仪器有:量筒、胶头滴管、500ml容量瓶、烧杯、玻璃棒;根据稀释定律可知,稀释前后溶质物质的量不变,则可得0.5L×0.1mol/L×98g/mol=VmL×1.84 g/mL×98%,解得V=2.7mL,应量取2.7mL 98%的浓硫酸;
故答案为:量筒、胶头滴管、500ml容量瓶、烧杯、玻璃棒;2.7;
②量筒在使用前已洗干净但不干燥,量取硫酸的浓度偏低,对结果是造成影响,某同学认为将量筒内的浓硫酸倒出之后,应将量筒洗涤—下并将洗涤液倒入烧杯中,最后转移到容量瓶中,量筒不需要洗涤,做法错;
故答案为:是;错;
③A. 未经冷却趁热将溶液注入容量瓶中,则定容时加入的水的体积偏小,结果浓度偏大,大于0.1mol/L,A项正确;
B. 摇匀后发现液面低于刻度线,再加水至刻度线,则加入的水的体积偏大,结果浓度偏小,小于0.1mol/L,B项错误;
C. 容量瓶中原有少量蒸馏水,不影响,C项错误;
D. 定容时俯视观察液面,则加入的水的体积偏小,结果浓度偏大,大于0.1mol/L,D项正确;
故答案为:AD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
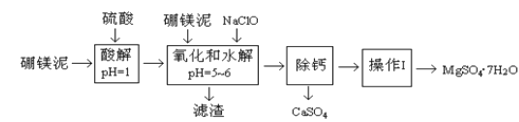
(1)实验中需要1 mol/L的硫酸980 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为____(填写选项字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有______,____。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法_____。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O。
(6)实验中提供的硼镁泥共100 g ,得到 MgSO47H2O 为196.8 g ,则MgSO47H2O 的产率为____。