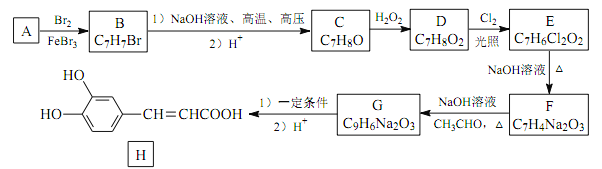
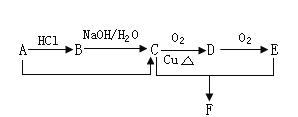
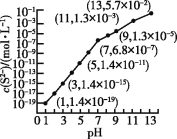
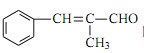题目内容
【题目】由一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸.再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为
A. 0.1molB. 大于或等于0.2mo1,小于0.3molC. 等于0.2 molD. 大于0.1mol小于0.3mol
【答案】C
【解析】
一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),混合气体的物质的量为0.4mol,混合气体在足量氧气中充分燃烧生成二氧化碳和水;NaOH溶液吸收二氧化碳,所以NaOH溶液增重26.4g为二氧化碳质量,结合二氧化碳质量根据碳原子守恒计算碳原子平均数,将一氧化碳和甲烷看作整体,根据平均碳原子列式计算。
一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),混合气体的物质的量为:![]() =0.4mol,
=0.4mol,
浓硫酸吸收水、NaOH溶液吸收二氧化碳,故NaOH溶液增重26.4g为二氧化碳质量,所以二氧化碳的物质的量为:![]() =0.6mol,
=0.6mol,
所以平均组成中平均碳原子数为:![]() =1.5,
=1.5,
一氧化碳、甲烷分子中都含有一个碳原子,可以看做1个组分,
设CO、甲烷的总物质的量为x,乙烷的物质的量为y,则:![]() =1.5,
=1.5,
解得:x=y,
则原混合气体中乙烷的物质的量为:0.4mol×![]() =0.2mol,
=0.2mol,
答案选C。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目