题目内容
【题目】还原法处理氮的氧化物是环境科学研究的热点课题。
I.氢气还原法。H2还原NO发生的反应为2NO(g)+2H2(g)![]() N2(g)+2H2O(g)。
N2(g)+2H2O(g)。
(1)已知几种化学键的键能数据如下:

2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=__________kJ·mol-1
N2(g)+2H2O(g) △H=__________kJ·mol-1
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1(反应慢):2NO(g)+H2(g)![]() N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2(反应快):H2O2(g)+H2(g)![]() 2H2O(g)
2H2O(g)
上述两步反应中,活化能较大的是反应__________(填“1”或“2”)。c(NO)对总反应速率的影响程度__________c(H2)(填“大于”“小于”或“等于”)。
II.NH3还原法。在恒容密闭容器中充入NH3和NO2;在一定温度下发生反应: 8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)
7N2(g)+12H2O(g)
(3)下列表明该反应达到平衡状态的是__________(填字母)。
A 混合气体密度保持不变 B NO2和N2的消耗速率之比为6:7
C 混合气体中c(N2)=c(NO2) D 混合气体压强保持不变
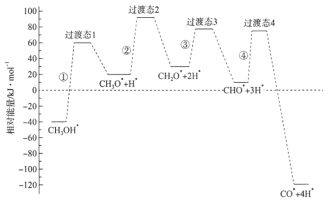
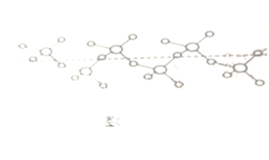
III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应: 2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H。在2L恒容密闭容器中充入2 mol CO和2 mol NO,测得NO的转化率与温度、时间的关系如图所示。
N2(g)+2CO2(g) △H。在2L恒容密闭容器中充入2 mol CO和2 mol NO,测得NO的转化率与温度、时间的关系如图所示。
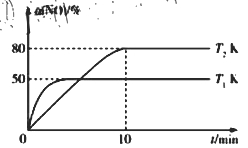
(4)下列说法正确的是_________(填字母)。
A 图像中,T1>T2 B 上述反应在高温下能自发进行
C 10min时,T2K下正、逆反应速率相等 D 增大NO的浓度,反应物的转化率增大
(5)T2K温度下,0-10min内用CO表示的平均反应速率v(CO)=_________mol/L-1·min-1;T1K温度下,上述反应的平衡常数K=_________L·mol-1。
(6)T1K温度下,向平衡后的容器内再加入2 mol N2和2 mol NO,则平衡_________(填“向右移动”“向左移动”或“不移动”)。
【答案】-666 1 大于 BD AC 0.08 1 向右移动
【解析】
(1)△H=断键吸收的总能量—成键释放的总能量,故该反应的△H=(2×630+2×436)kJ·mol-1-(946+4×463) kJ·mol-1=-666 kJ·mol-1。
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2),反应1:2NO(g)+H2(g)
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2),反应1:2NO(g)+H2(g)![]() N2(g)+H2O2(g);反应2:H2O2(g)+H2(g)
N2(g)+H2O2(g);反应2:H2O2(g)+H2(g)![]() 2H2O(g)。总反应速率由反应较慢的一步决定,则反应1反应速率慢活化能高,由反应速率表达式可知c(NO)对总反应速率的影响程度大于c(H2)。
2H2O(g)。总反应速率由反应较慢的一步决定,则反应1反应速率慢活化能高,由反应速率表达式可知c(NO)对总反应速率的影响程度大于c(H2)。
(3)恒容容器中8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)
7N2(g)+12H2O(g)
A.反应前后气体总质量和总体积不变,故密度恒定不变,无法说明达到平衡,A错误;
B.反应达到平衡,正反应速率等于逆反应速率,故NO2和N2的消耗速率之比为6:7,B正确;
C.c(N2)=c(NO2)浓度相等不等于反应速率相等,C错误;
D.反应为增压反应,容器中压强不变则可证明反应达到平衡,D正确;
答案选BD。
(4)对于反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
A.由图像可知初始反应速率T1>T2,则温度T1>T2,A正确;
B. T1>T2平衡时转化率T1<T2,则ΔH<0,ΔS<0反应能自发进行![]() ;则反应在低温下能自发进行,B错误;
;则反应在低温下能自发进行,B错误;
C. 10min时反应达到平衡,T2K下正、逆反应速率相等,C正确;
D. 增大NO的浓度平衡正移,NO转化率减小,D错误;
答案选AC。
(5)T2K温度下,0~10min内,NO转化率为80%,则反应的NO物质的量为![]() ,则参与反应的CO物质的量为1.6mol
,则参与反应的CO物质的量为1.6mol![]() ;T1K温度下
;T1K温度下
则平衡常数K=![]()
(6)T1K温度下,向平衡后的容器内再加入2molN2和2molNO,则浓度商Q=![]() <1,故平衡正移。
<1,故平衡正移。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
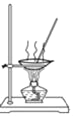
小学生10分钟应用题系列答案【题目】I.50 mL 1.0mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
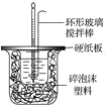
(1)___(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。
(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是__(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量__(填“增加”“减少”或“不变”);所求中和热数值__(填“增加”“减少”或“不变”)。
(4)__(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cmΔt,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,Δt表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 g·cm-3,中和后混合液的比热容c=4.184×10﹣3kJ·g-1·℃-1则该反应的中和热为ΔH=__(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是__(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
II. 草酸与高锰酸钾在酸性条件下能够发生反应:
现用 0.1 mol/L KMnO4酸性溶液与0.5 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。实验过程的数据记录 (见表格),请结合表中信息,回答有关问题:
0.1
实验 序号 | 反应温度/℃ | 参加反应的物质 | |||||
KMnO4(H2SO4) | H2C2O4 | H2O | MnSO4 | ||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | G | ||
A | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
B | 20 | 10 | 0.1 | 6 | 0.5 | V1 | 0 |
C | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 1 |
D | 50 | 10 | 0.1 | 6 | 0.5 | 0 | 0 |
E | 40 | 10 | 10 | 0.5 | 0 | 0 | |
(1)写出反应的化学方程式____________________________________;
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用A~E表示,下同)
(3)如果研究温度对化学反应速率的影响,使用实验________和________;