题目内容
【题目】“84消毒液”(主要成分为NaClO)能有效杀灭新型冠状病毒,某化学小组对“84消毒液”的制备和性质进行研究。请回答下列问题:
I.甲同学查阅资料知道可以利用氯气与氢氧化钠溶液反应制取“84消毒液”,同时发现“在加热情况下卤素与碱液发生如下反应:3X2+6OH-→5X-+XO3-+3H2O”。由此设计了如下装置。
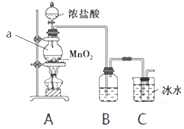
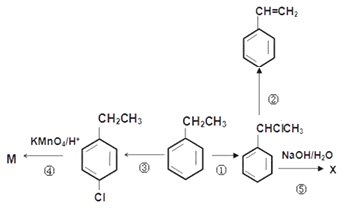
(1)仪器a的名称为__________,B中所用试剂为__________。
(2)A中发生反应的离子方程式为________。
(3)有同学认为该实验存在明显的缺陷,如何改进:________。
II.乙同学阅读某“84消毒液”的包装说明得到以下信息:
严禁与洁厕灵(主要成分盐酸)同时使用。
有效氯含量在5%以上。
有效氯含量用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征。
(1)“84消毒液”与洁厕灵同时使用会产生有毒的氯气,写出反应的离子方程式___。
(2)乙同学进行如下实验测定有效氯:
步骤一:取C中大试管溶液5 g于锥形瓶,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液。
步骤二:用0.1000 mol·L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00 mL Na2S2O3溶液。(I2+2S2O32-=2I-+S4O62-)
步骤一反应的离子方程式为________。通常选用__________作指示剂,滴定至终点的现象________。此消毒液有效氯含量为__________%(保留二位有效数字)。
【答案】圆底烧瓶 饱和食盐水 ![]() 在C装置后增加一个装有NaOH溶液的烧杯作为尾气处理装置
在C装置后增加一个装有NaOH溶液的烧杯作为尾气处理装置 ![]()
![]() 淀粉溶液 当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色 1.4%
淀粉溶液 当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色 1.4%
【解析】
装置A制备氯气,利用装置B除去氯气中的氯化氢,利用装置C制备次氯酸钠,结合物质的性质和问题分析解答。
I.(1)仪器a的名称为圆底烧瓶;实验室中利用浓盐酸与二氧化锰反应制取氯气,制取的氯气中含有杂质HCl,装置B用来除去杂质HCl,所用试剂为饱和食盐水。
(2)A中浓盐酸与二氧化锰发生反应,离子方程式为![]() 。
。
(3)氯气有毒,需要进行尾气处理,需要在C装置后增加一个装有NaOH溶液的烧杯作为尾气处理装置。
II. (1)“84消毒液”与洁厕灵同时使用会产生有毒的氯气,原因是NaClO与盐酸发生氧化还原反应,离子方程式为![]() 。
。
(2)步骤一中I-与试管C中的ClO-发生氧化还原反应,离子方程式为![]() 。碘单质遇淀粉显蓝色,故通常选用淀粉溶液作指示剂,滴定至终点的现象当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色。根据步骤一、二反应方程式可知,n(ClO-)=n(I2)=
。碘单质遇淀粉显蓝色,故通常选用淀粉溶液作指示剂,滴定至终点的现象当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色。根据步骤一、二反应方程式可知,n(ClO-)=n(I2)=![]() n(S2O32-)= 0.1000 mol·L-1×20.00 ×10-3L×
n(S2O32-)= 0.1000 mol·L-1×20.00 ×10-3L×![]() =0.001mol。有效氯含量用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,因2H++ClO-+Cl-=Cl2↑+H2O,故此消毒液有效氯含量
=0.001mol。有效氯含量用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,因2H++ClO-+Cl-=Cl2↑+H2O,故此消毒液有效氯含量![]() 。
。