题目内容
【题目】I.50 mL 1.0mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
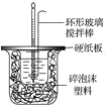
(1)___(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。
(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是__(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量__(填“增加”“减少”或“不变”);所求中和热数值__(填“增加”“减少”或“不变”)。
(4)__(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cmΔt,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,Δt表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 g·cm-3,中和后混合液的比热容c=4.184×10﹣3kJ·g-1·℃-1则该反应的中和热为ΔH=__(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是__(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
II. 草酸与高锰酸钾在酸性条件下能够发生反应:
现用 0.1 mol/L KMnO4酸性溶液与0.5 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。实验过程的数据记录 (见表格),请结合表中信息,回答有关问题:
实验 序号 | 反应温度/℃ | 参加反应的物质 | |||||
KMnO4(H2SO4) | H2C2O4 | H2O | MnSO4 | ||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | G | ||
A | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
B | 20 | 10 | 0.1 | 6 | 0.5 | V1 | 0 |
C | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 1 |
D | 50 | 10 | 0.1 | 6 | 0.5 | 0 | 0 |
E | 40 | 10 | 10 | 0.5 | 0 | 0 | |
(1)写出反应的化学方程式____________________________________;
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用A~E表示,下同)
(3)如果研究温度对化学反应速率的影响,使用实验________和________;
【答案】不能 偏低 增加 不变 不能 -56.5kJ∕mol abcd 2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+H2O A C A E
【解析】
I.中和热的测定实验,需要准确测定出反应放出的热量,因此保温措施是关键;根据公式Q=cmΔt来求出生成0.05mol的水放出热量,最后根据中和热的概念求出中和热;
II.(1)硫酸酸化的KMnO4有强氧化性,与H2C2O4反应生成硫酸钾、硫酸锰、二氧化碳和水,结合电子守恒和原子守恒配平方程式;
(2)研究催化剂对化学反应速率的影响,只有催化剂不同;
(3)研究温度对化学反应速率的影响,只有温度不同。
I.(1)不能将环形玻璃搅拌棒改为环形金属(如铜)棒,因为环形金属棒是热的良导体,会造成热量损失;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会偏低;
(3)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL 0.50mol·L-1的盐酸与50mL 0.55mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增加;但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,因此求得的中和热的数值不变;
(4)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,测得的反应热包括了生成BaSO4沉淀的反应热,并不是中和热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热;
(5)3次反应前后温度差分别为:7.6℃、6.7℃、6.8℃,第一组舍去,平均值为6.75℃,50mL1.0mol·L-1盐酸跟50mL1.1mol·L-1氢氧化钠溶液的质量和m=100mL×1g·mL-1=100g,c=4.18J/(g·℃),代入公式Q=cm△t,得生成0.05mol水放出热量Q=4.184J/(g·℃)×100g×6.75℃=2.8224kJ,所以生成1mol的水放出热量为2.8224kJ×20=56.5kJ,即该实验测得的中和热△H=-56.5kJ·mol-1;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,a正确;
b.量取NaOH溶液时仰视读数,使所量的氢氧化钠体积偏大,但该反应HCl不足,放出热量不变,导致温度差偏小,测得的热量偏小,中和热的数值偏小,b正确;
c.尽量一次快速将NaOH溶液倒入盛有盐酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有盐酸的小烧杯中,因为多次倒入热量损失越多,测得的数据越小,c正确;
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度,HCl溶液的起始温度偏高,测得的热量偏小,中和热的数值偏小,d正确。
答案为:abcd;
II.(1)酸化的KMnO4有强氧化性,与H2C2O4反应生成硫酸钾、硫酸锰、二氧化碳和水,反应的方程式为2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+H2O,
(2)研究催化剂对化学反应速率的影响,只有催化剂不同,使用实验A和C;
(3)研究温度对化学反应速率的影响,只有温度不同,利用实验A和E。