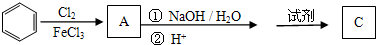题目内容
19.某无色溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,证明一定含有SO42-,这样的说法对吗?为什么?如何改进?分析 BaCl2溶液中含有钡离子和氯离子,钡离子能形成硫酸钡沉淀,氯离子能形成氯化银沉淀,二者都是不溶于稀HNO3的白色沉淀,白色沉淀可能为氯化银或硫酸钡,硫酸根离子能与钡离子结合生成硫酸钡沉淀,检验SO42-离子应排除SO32-、CO32-和Ag+的干扰.
解答 解:向某溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,白色沉淀可能是硫酸钡或氯化银,发生的反应如:Na2SO4+BaCl2=BaSO4↓+2NaCl,也可能为BaCl2+2AgNO3=Ba(NO3)2+2AgCl↓,则未知溶液中可能大量存在硫酸根离子、银离子中的至少一种离子,所以不能证明一定含有SO42-,
检验硫酸根离子的方法为:取少量溶液于试管中,加入稀盐酸,没有明显现象,排除SO32-、CO32-和Ag+,硫酸根离子能与钡离子结合生成硫酸钡沉淀,再加入氯化钡溶液,产生白色沉淀,则证明溶液中有SO42-,
答:不能证明一定含有SO42-,检验硫酸根离子的方法为:取少量溶液于试管中,加入稀盐酸,没有明显现象,排除SO32-、CO32-和Ag+,硫酸根离子能与钡离子结合生成硫酸钡沉淀,再加入氯化钡溶液,产生白色沉淀,则证明溶液中有SO42-.
点评 本题考查离子的检验,注意化学中不溶于稀硝酸的白色沉淀常见的有硫酸钡和氯化银两种,不溶性碱和碳酸盐沉淀都溶于稀硝酸,排除离子的干扰是解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
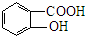
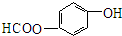
11.下列各组有机物中.肯定属于同系物的-组是( )
| A. | C3H8 C5H12 | B. | C4H6 C3H4 | C. | C2H60 C3H8O | D. | C3H6O C2H4O |
13.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2 粗品.
②有关物质的部分性质如上表:
设计实验装置图如下:
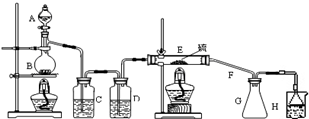
请回答下列问题:
(1)B 中反应的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;E 中反应的化学方程式2S+C12$\frac{\underline{\;\;△\;\;}}{\;}$S2C12.
(2)C、D 中的试剂分别是饱和食盐水、浓硫酸.
(3)如果在加热E时温度过高,对实验结果的影响是S2Cl2因温度过高会分解.
(4)根据S2Cl2的性质,在述实验装置中G、H之间应添加干燥装置.
| 物质 | 熔点/℃ | 沸点 | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S,300℃以上完全分解,S2Cl2+Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2 |
②有关物质的部分性质如上表:
设计实验装置图如下:

请回答下列问题:
(1)B 中反应的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;E 中反应的化学方程式2S+C12$\frac{\underline{\;\;△\;\;}}{\;}$S2C12.
(2)C、D 中的试剂分别是饱和食盐水、浓硫酸.
(3)如果在加热E时温度过高,对实验结果的影响是S2Cl2因温度过高会分解.
(4)根据S2Cl2的性质,在述实验装置中G、H之间应添加干燥装置.
14.实验室利用反应2H2O2═2H2O+O2↑可制备氧气.取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如表所示.
实验1、2研究的是温度对H2O2分解速率的影响.
实验2、3的目的是不同催化剂对过氧化氢分解速率的影响.
实验中可以表明该反应速率差异的现象是产生气泡的快慢.
| 序号 | 条件 | |
| 温度/℃ | 催化剂 | |
| 1 | 40 | FeCl3溶液 |
| 2 | 20 | FeCl3溶液 |
| 3 | 20 | MnO2 |
| 4 | 20 | 无 |
实验2、3的目的是不同催化剂对过氧化氢分解速率的影响.
实验中可以表明该反应速率差异的现象是产生气泡的快慢.

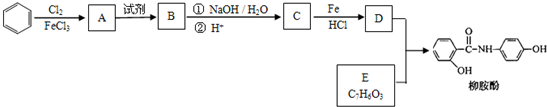
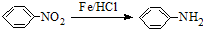 .请回答下列问题:
.请回答下列问题: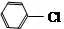
 .
. .
.