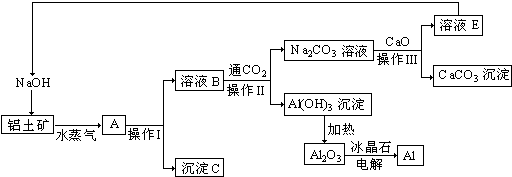
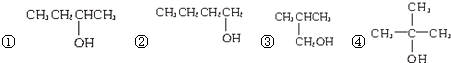题目内容
4.某氯化镁溶液的密度是1.18g/cm3,其中镁离子的质量分数为5.1%,则300mL该溶液中的镁离子的物质的量浓度为2.5mol/L.分析 根据m=ρV计算氯化镁溶液的质量,根据m((Mg2+)=m(溶液)×ω((Mg2+)计算镁离子质量,再根据n=$\frac{m}{M}$计算镁离子的物质的量,从而求出镁离子的浓度.
解答 解:氯化镁溶液的质量为:1.18g•cm-3×300mL=354g,
镁离子的质量为:354g×5.1%=3.54×5.1g,
镁离子的物质的量为:$\frac{3.54×5.1g}{24g/mol}$=0.75mol,
故溶液中c(Mg2+)=$\frac{0.75mol}{0.3L}$=2.5mol/L.
故答案为:2.5mol/L.
点评 考查物质的量浓度、质量分数、常用化学计量的有关计算,比较基础,注意公式的灵活运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.A、B、C、D为短周期元素,在元素周期表中的位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数.下列叙述不正确的是( )
| A | C | |
| B | D |
| A. | 气态氢化物的稳定性:HC>HD | |
| B. | 最高价氧化物对应水化物的酸性:H2BO4>HDO4 | |
| C. | 单质沸点最高的是B元素形成的单质 | |
| D. | A简单气态氢化物水溶液显碱性 |
19.下表中是一些化学键键能的数据
根据上述数据回答(1)~(3)题
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)X2+H2=2HX(X代表卤族原子)的反应是放热反应(填“吸热”或“放热”)
(3)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,放出或吸收的热量最多的是F2.
| 化学键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)X2+H2=2HX(X代表卤族原子)的反应是放热反应(填“吸热”或“放热”)
(3)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,放出或吸收的热量最多的是F2.
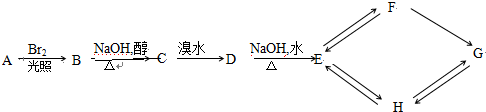
 .
.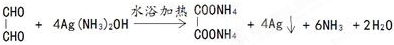 .
.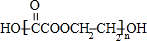 .
.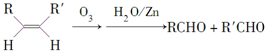
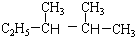 )的系统命名法的名称是2,3-二甲基戊烷;
)的系统命名法的名称是2,3-二甲基戊烷;