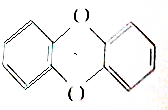
题目内容
14.将表面已部分被氧化为氧化钠的金属钠样品5.4g放入40g水中,放出0.1g H2.(1)写出该样品放入水中时发生反应的化学方程式:
2Na+2H2O=2NaOH+H2↑,
Na2O+H2O=2NaOH;
根据以上方程式可知反应后溶液碱(填“酸”“碱”或“中”)性.
(2)样品中含Na2.3g,Na2O3.1g.
分析 (1)钠与水反应生成氢氧化钠与氢气,氧化钠与水反应生成氢氧化钠,所得溶液为氢氧化钠溶液;
(2)样品为Na、Na2O混合物,根据氢气质量计算Na的质量,氧化钠质量=样品质量-Na的质量.
解答 解:(1)钠与水反应生成氢氧化钠与氢气,氧化钠与水反应生成氢氧化钠,反应方程式为:2Na+2H2O=2NaOH+H2↑、Na2O+H2O=2NaOH,所得溶液为氢氧化钠溶液,溶液呈碱性,
故答案为:2Na+2H2O=2NaOH+H2↑;Na2O+H2O=2NaOH;碱;
(2)样品为Na、Na2O混合物,设Na的质量为m,则:
2Na+2H2O=2NaOH+H2↑
46 2
m 0.1g
所以m=$\frac{0.1g×46}{2}$=2.3g
故Na2O的质量为5.4g-2.3g=3.1g
故答案为:2.3;3.1.
点评 本题考查混合物有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
5.1mol有机物 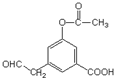 分别与足量Na、NaOH水溶液、H2反应,试剂最大用量正确的是( )
分别与足量Na、NaOH水溶液、H2反应,试剂最大用量正确的是( )
 分别与足量Na、NaOH水溶液、H2反应,试剂最大用量正确的是( )
分别与足量Na、NaOH水溶液、H2反应,试剂最大用量正确的是( )| Na | NaOH | H2 | |
| A | 1mol | 1mol | 3mol |
| B | 2mol | 2mol | 5mol |
| C | 1mol | 3mol | 4mol |
| D | 1mol | 3mol | 5mol |
| A. | A | B. | B | C. | C | D. | D |
2.有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液可能是( )

则甲、乙、丙三种溶液可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2CO3 |
6.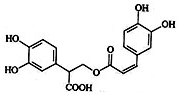 迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
下列叙述正确的是( )
 迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图. 下列叙述正确的是( )
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生加成反应、取代反应和酯化反应 | |
| D. | 迷迭香酸的化学式为C18H18O8 |
8.某粉煤灰经预处理后含Cu2O、SiO2、Al2O3、FeO化合物,一种综合利用工艺设计的流程如下:

已知:①Cu2O+2H+=Cu+Cu2++H2O
②生成氢氧化物沉淀的pH:
(1)写出用H2O2氧化溶液的离子方程式2 Fe 2++H2O2+2H+═2 Fe3++2H2O.
(2)验证煤粉灰含有FeO必要的化学试剂为稀硫酸、KMnO4溶液 (或稀盐酸、K3[Fe(CN)6]溶液).
(3)滤渣Ⅰ的主要成分为Cu、SiO2(填化学式),滤渣Ⅱ的主要成分为Fe (OH)3、Cu(OH)2(填化学式)
(4)物质X的化学式为CO2.“碱溶”时反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)为了获得产品Al(OH)3,从粉煤灰的盐酸浸取后的溶液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.2,过滤得到Al(OH)3_.

已知:①Cu2O+2H+=Cu+Cu2++H2O
②生成氢氧化物沉淀的pH:
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)验证煤粉灰含有FeO必要的化学试剂为稀硫酸、KMnO4溶液 (或稀盐酸、K3[Fe(CN)6]溶液).
(3)滤渣Ⅰ的主要成分为Cu、SiO2(填化学式),滤渣Ⅱ的主要成分为Fe (OH)3、Cu(OH)2(填化学式)
(4)物质X的化学式为CO2.“碱溶”时反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)为了获得产品Al(OH)3,从粉煤灰的盐酸浸取后的溶液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.2,过滤得到Al(OH)3_.


 (1)如图为金刚烧的空间结构(碳架)
(1)如图为金刚烧的空间结构(碳架)