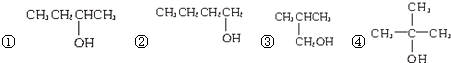题目内容
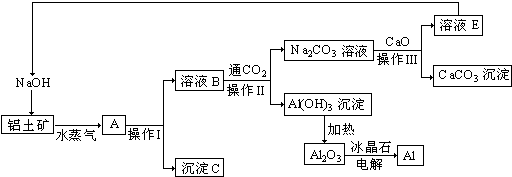
7.实验室中可用如图所示甲装置制取少量蒸馏水.
(1)该操作的名称为蒸馏,能否用乙装置代替甲装置完成该实验能(填“能”或“不能”)
(2)图中仪器a、b、c、d的名称分别是圆底烧瓶、冷凝管、蒸馏烧瓶、锥形瓶.
(3)实验时仪器b中应通水,其正确的方法是B(填字母),仪器a中加入几片碎瓷片,其作用是防止爆沸.
A.e口进水,f口出水
B.f口进水,e口出水
(4)简述结束实验的时机及正确的操作顺序:沸程结束温度到达并稳定到最高点5分钟(不得蒸干),结束的时候要先停止加热,等没有流出物的时候再停止冷凝水,拆除设备..
分析 水沸点较低,水中的杂质难挥发,可用蒸馏制取蒸馏水,为防止爆沸应加入碎瓷片,冷凝水应从下口进入上口流出,结束时,应先停止加热,等没有流出物的时候再停止冷凝水,据此解答.
解答 解:(1)制取蒸馏水可以通过水蒸馏的实验得到;乙图是蒸馏实验的准确装置,可以用来制取蒸馏水;
故答案为:蒸馏;能;
(2)图中仪器a、b、c、d的名称分别是:圆底烧瓶,冷凝管,蒸馏烧瓶,锥形瓶;
故答案为:圆底烧瓶,冷凝管,蒸馏烧瓶,锥形瓶;
(3)为达到最佳冷凝效果,冷凝水流向与蒸汽流向逆向,所以冷凝水应从下口进入上口流出,故选B;为防止爆沸,可以加入几块碎瓷片;
故答案为:B;为防止爆沸;
(4)蒸馏实验结束时机:沸程结束温度到达并稳定到最高点5分钟(不得蒸干);正确操作:结束的时候要先停止加热,等没有流出物的时候再停止冷凝水,拆除设备;
故答案为:沸程结束温度到达并稳定到最高点5分钟(不得蒸干);结束的时候要先停止加热,等没有流出物的时候再停止冷凝水,拆除设备;
点评 本题考查了蒸馏水制取的实验,明确蒸馏实验的原理及操作是解题关键,题目难度不大.

练习册系列答案
相关题目
17.下列事实能用勒夏特列原理来解释的是( )
| A. | 实验室采用排饱和食盐水的方法收集氯气 Cl2+H2O?H++Cl-+HClO | |
| B. | 500℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0 | |
| C. | H2、I2、HI平衡混合气体加压后颜色加深 H2(g)+I2(g)?2HI(g) | |
| D. | SO2氧化为SO3,往往需要使用催化剂 2SO2(g)+O2(g)?2SO3(g) |
18.下列实验事实不能用基团间相互作用来解释的是( )
| A. | 苯酚能与NaOH溶液反应而乙醇不能 | |
| B. | 与Na反应时,乙醇的反应速率比水慢 | |
| C. | 乙醇能被酸性重铬酸钾溶液氧化而乙酸不能 | |
| D. | 苯、甲苯发生硝化反应生成一硝基取代产物时,甲苯的反应温度更低 |
2.有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液可能是( )

则甲、乙、丙三种溶液可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2CO3 |
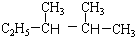 )的系统命名法的名称是2,3-二甲基戊烷;
)的系统命名法的名称是2,3-二甲基戊烷;