题目内容
【题目】如图是一个化学过程的示意图. 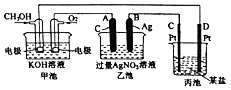
(1)通入O2的电极名称、C(Pt)电极的名称是 .
(2)写出通入O2的电极上的电极反应式是 .
(3)写出通入CH3OH的电极上的电极反应式是 .
(4)若丙池是电解饱和食盐水溶液,则阳极的电极反应为 , 阴极的电极反应为 . 在(阳极或阴极)附近滴入酚酞溶液变红.
(5)乙池中反应的化学方程式为 .
(6)当乙池中B(Ag)极的质里增加5.40g时,甲池中理论上消耗O2mL(标准状况下);若丙池中饱和食盐水溶液的体枳为500mL,电解后,溶液的pH= . (25℃,假设电解前后溶液的体积无变化).
【答案】
(1)正极;阳极
(2)O2+2H2O+4e﹣=4OH﹣
(3)CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O
(4)2Cl﹣﹣2e﹣=Cl2↑;2H++2e﹣=H2↑;阴极
(5)2H2O+4AgNO3![]() 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
(6)280;13
【解析】解:燃料电池中,通入燃料的电极为负极,电极反应为CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O,通入氧化剂的电极为正极,正极反应为O2+4e﹣+2H2O=4OH﹣,乙池、丙池是电解池,与电源正极相连的是阳极,与电源负极相连的是阴极,则A是阳极、B是阴极,乙池中阳极、阴极电极反应分别为4OH﹣﹣4e﹣=O2↑+2H2O、Ag++e﹣=Ag,丙池中C是阳极,D是阴极,电解质溶液是氯化钠溶液,氢离子在阴极放电,氯离子在阳极放电.(1)通入O2的电极是正极,C(Pt)电极的名称是阳极,所以答案是:正极;阳极;(2)通入O2的电极上的电极反应式是O2+4e﹣+2H2O=4OH﹣,所以答案是:O2+4e﹣+2H2O=4OH﹣;(3)燃料电池中,通入燃料的电极为负极,电极反应为CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O,所以答案是:CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O;(4)丙池中C是阳极,D是阴极,电解质溶液是氯化钠溶液,氯离子在阳极失电子产生氯气,电极反应为:2Cl﹣﹣2e﹣=Cl2↑,氢离子在阴极得到电子产生氢气,电极反应为:2H++2e﹣=H2↑,水的电离平衡被破坏,氢氧根离子的浓度增大,该区域溶液呈碱性,滴入酚酞溶液变红,
所以答案是:2Cl﹣﹣2e﹣=Cl2↑;2H++2e﹣=H2↑;阴极;(5)乙池中A是阳极、B是阴极,阳极水电离出的氢氧根失电子产生氧气,阴极银离子得电子产生单质银,属于放氧生酸型,电解反应的化学方程式为:2H2O+4AgNO3 ![]() 4Ag+O2↑+4HNO3,所以答案是:2H2O+4AgNO3
4Ag+O2↑+4HNO3,所以答案是:2H2O+4AgNO3 ![]() 4Ag+O2↑+4HNO3;(6)当乙池中B(Ag)极的质量增加5.40g时,根据Ag++e﹣=Ag,转移电子为:
4Ag+O2↑+4HNO3;(6)当乙池中B(Ag)极的质量增加5.40g时,根据Ag++e﹣=Ag,转移电子为: ![]() =0.05mol,根据O2+4e﹣+2H2O=4OH﹣,甲池中理论上消耗O2的体积是:
=0.05mol,根据O2+4e﹣+2H2O=4OH﹣,甲池中理论上消耗O2的体积是: ![]() ×22.4L/mol=0.28L=280mL,产生氢氧根的物质的量为:0.05mol,c(OH﹣)=
×22.4L/mol=0.28L=280mL,产生氢氧根的物质的量为:0.05mol,c(OH﹣)= ![]() =
= ![]() =0.1mol/L,则溶液pH=13,
=0.1mol/L,则溶液pH=13,
所以答案是:280;13.

【题目】在一恒定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热). 若增大压强,则平衡常数(填序号). A.一定不变 B.一定减小 C.一定增大 D.增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO)=c(CO2)


