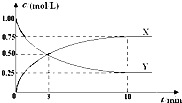
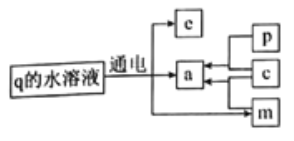
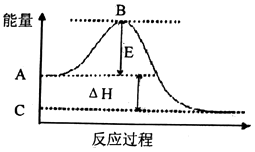
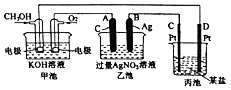
题目内容
【题目】A、B、C、D、E、F为原子序数依次增大的前36号元素,其中只有两种金属元素。A与C同主族,B与E同主族;B与C能形成两种常见化合物;C与F最外层只有1个电子,且内层均已排满;基态D原子成对电子数是未成对电子数的4倍。
请问答下列问題:
(1)基态B原子的轨道表达式为______,其最高能级的电子云有_____个不同的伸展方向。
(2)B、C、E原子半径由大到小的顺序为_________(用元素符号表示)。
(3)D和E中第一电离能较大的是_______(填元素符号),原因为___________。
(4)A与B形成的最简单化合物比A与E形成的最简单化合物的熔点______(填“高“或“低”),原因为___________。
(5)D的最高价氧化物对应的水化物中,D原子的杂化轨道类型为______,已知该分子中除氢外其他原子均满足最外层8电子稳定结构,则其结构式为________。
(6)单质F及其同族元素P、Q的堆积模型均为面心立方最密堆积,三种原子的半径分别为128pm、144pm、144pm,其中P和Q的相对原子质量分别为Mτ(P)、Mτ(Q)。
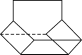
①单质F中的配位数为______;密度为_____g/cm3(用NA表示阿伏加德罗常数的值,列式即可)。
②单质P和Q的密度之比为________[用含Mτ(P)、Mτ(Q)的代数式表示]。
【答案】 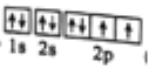 3 Na>S>O P P的3p轨道处于半充满状态,较难失去1各电子 高 水分子间较易形成氢键 sp3
3 Na>S>O P P的3p轨道处于半充满状态,较难失去1各电子 高 水分子间较易形成氢键 sp3  12
12 ![]()
![]()
【解析】根据题意可推断A、B、C、D、E、F分别为H、O、Na、P、S、Cu。
(1)基态B原子的轨道表达式为![]() 其最高能级的电子云有3个不同的伸展方向。
其最高能级的电子云有3个不同的伸展方向。
(2)根据电子层数和核内质子数的关系可得原子半径:r(Na)>r(S)>r(O)。
(3)P的3p轨道处于半充满状态,较难失去一个电子,所以第一电离能较大。
(4)水分子间较易形成氢键,所以熔点较高。
(5)D的最高价氧化物对应的水化物为H3PO4,分子的中心P原子为sp3杂化,除氢外其他原子均满足最外层8电子稳定结构,可知P与O之间形成了一个配位键,结构式为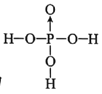 。
。
(6)①面心立方最密堆积的配位数为12;其密度为![]() 。
。
②P与Q的堆积方式相同,原子半径相同,所以密度之比即为摩尔质量之比,即相对原子质量之比。

 习题精选系列答案
习题精选系列答案