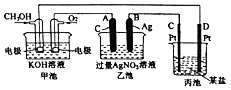
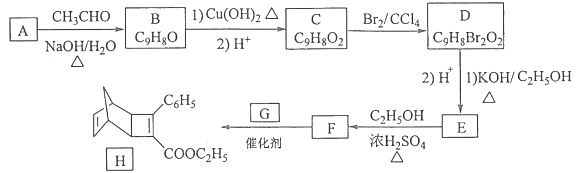
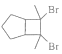
题目内容
【题目】测血钙的含量时,进行如下实验: ①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉徙用稀硫酸处理得H2C2O4溶液.
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2 , 还原产物为Mn2+ .
③终点时用去20mL 1.0×l0﹣4 mol/L的KMnO4溶液.
(1)写出用KMnO4滴定H2C2O4的离子方程式 .
(2)判断滴定终点的方法是 .
(3)③步骤中取酸性KMnO4溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的血钙质量分数(填“偏大”、“偏小”或“无影响”).
(4)计算:血液中含钙离子的浓度为mol/L.
【答案】
(1)2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色
(3)偏大
(4)2.5×10﹣3
【解析】解:(1)用酸性KMnO4溶液滴定H2C2O4溶液,高锰酸钾具有强氧化性能氧化草酸发生氧化还原反应生成二氧化碳,锰离子和水,反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
所以答案是:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;(2)判断滴定终点的方法是:当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色,
所以答案是:当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色;(3)③步骤中取酸性KMnO4溶液时,酸式滴定管用蒸馏水洗过后没有润洗,消耗高锰酸钾溶液体积增大,计算测得的血钙质量分数偏大,
所以答案是:偏大;(4)定量关系可知,
5CaC2O4~5H2C2O4~ | 2KMnO4 |
5 | 2 |
n | 0.020L×1.0×10﹣4 mol/L |
n=5.0×10﹣6mol,
血液中含钙离子的浓度= ![]() =2.5×10﹣3,
=2.5×10﹣3,
所以答案是:2.5×10﹣3;

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用铬,通常采用如下流程处理:
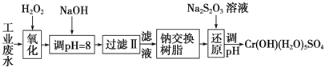
注:部分阳离子常温下沉淀时的pH见下表
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀pH | 1.4 | 7 | 9.1 | 3.4 | 4.3 |
完全沉淀pH | 3.7 | 9.6 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)氧化过程主要是氧化Fe2+和Cr3+,氧化Fe2+的目的是:________________;其中Cr3+被氧化为Cr2O72-,该反应的离子方程式为:____________,氧化Cr3+的目的是__________。
(2)选择以下合适选项填空:加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是_____。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,氧化剂和还原剂的物质的量之比为:_________________。