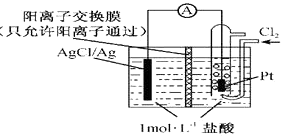
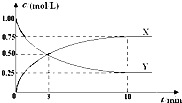
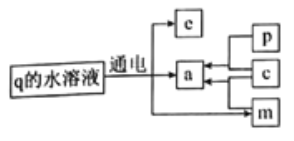
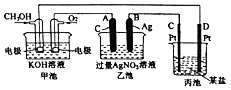
题目内容
【题目】常温下,0.1molL﹣1CH3COONa溶液pH=11,下列表述正确的是( )
A.c(Na+)=c(CH3COO﹣)
B.c(CH3COO﹣)+c(CH3COOH)=0.1 molL﹣1
C.由水电离出来的c(OH﹣)=1.0×10﹣11 molL﹣1
D.往该溶液中加入0.05 molL﹣1的CH3COONa,pH值变大
【答案】B
【解析】解:A、溶液中醋酸根离子水解显碱性、由电荷守恒可知c(H+)+c(Na+)=c(OH﹣)+c(CH3OO﹣),c(H+)<c(OH﹣),c(Na+)>c(CH3OO﹣),故A错误;
B、由溶液中物料守恒可知,c(CH3COO﹣)+c(CH3COOH)=0.1 molL﹣1,故B正确;
C、结合溶液中离子积常数计算水电离出的氢离子浓度,由水电离出来的c(OH﹣)= ![]() =1.0×10﹣3 molL﹣1,故C错误;
=1.0×10﹣3 molL﹣1,故C错误;
D、加水稀释,水解平衡正向进行,离子浓度减小,氢氧根离子浓度减小,pH减小,故D错误;
故选B.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案【题目】一种由富锰渣(含2MnO·SiO2、3MnO·Al2O3·3SiO2、FeO及重金属盐等)制备高纯MnCl2的工艺流程如下:

回答下列问题:
(1)“浸取”时的温度与四种元素的浸取率如图所示。

①工艺上控制75℃的主要原因是____________________________________________。
②铁和铝的浸出率从72℃明显下降的可能原因是___________________________________。
(2)“氧化”时发生反应的离子方程式为___________________________________________。
(3)通过调整pH可以“除铁和铝”。常温下,三种氢氧化物开始沉淀和沉淀完全(使其浓度小于1×10-6mol/L)的部分数据如下表:
Mn(OH)2 | Fe (OH)3 | Al(OH)3 | |
开始沉淀pH | 7.1 | 2.2 | 4. 1 |
沉淀完全pH | 10.8 | 3.5 | ? |
Al(OH)3沉淀完全的pH为______________{已知Ksp[Al(OH)3]=1×10-33};“调pH”时,应将溶液pH调整的范围是______________________。
(4)“除重金属”时,发生反应Hg2++MnS![]() HgS+M2+,其平衡常数K=___________[已知溶度积常数Ksp(HgS)=1.6×10-52,Ksp(MnS)=2.5×10-10,答案保留三位有效数学]。
HgS+M2+,其平衡常数K=___________[已知溶度积常数Ksp(HgS)=1.6×10-52,Ksp(MnS)=2.5×10-10,答案保留三位有效数学]。
(5)“步骤X”包含的操作有蒸发浓缩、__________、洗涤、干燥等。