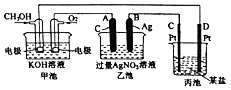
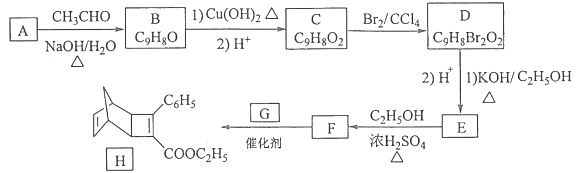
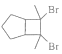
题目内容
【题目】在一恒定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热). 若增大压强,则平衡常数(填序号). A.一定不变 B.一定减小 C.一定增大 D.增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO)=c(CO2)
【答案】
(1)![]() ;放热;A
;放热;A
(2)BC
【解析】解:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,CO(g)+H2O(g)CO2(g)+H2(g)反应的平衡常数为:K= ![]() ;
;
化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数减小,说明化学平衡逆向移动,则正反应为放热反应;化学平衡常数只与温度有关,与压强大小无关,所以增大压强后平衡常数不变,
所以答案是: ![]() ;放热;A;(2)A.反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,不能根据压强判断平衡状态,故A错误;
;放热;A;(2)A.反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,不能根据压强判断平衡状态,故A错误;
B.混合气体中c(CO)不变,表明正逆反应速率相等,达到了平衡状态,故B正确;
C、化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(H2O)表明反应达到平衡状态,故C正确;
D、c(CO2)=c(CO)时,不能表明正逆反应速率相等,不一定达到了平衡状态,故D错误;
所以答案是:BC.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】一种由富锰渣(含2MnO·SiO2、3MnO·Al2O3·3SiO2、FeO及重金属盐等)制备高纯MnCl2的工艺流程如下:

回答下列问题:
(1)“浸取”时的温度与四种元素的浸取率如图所示。

①工艺上控制75℃的主要原因是____________________________________________。
②铁和铝的浸出率从72℃明显下降的可能原因是___________________________________。
(2)“氧化”时发生反应的离子方程式为___________________________________________。
(3)通过调整pH可以“除铁和铝”。常温下,三种氢氧化物开始沉淀和沉淀完全(使其浓度小于1×10-6mol/L)的部分数据如下表:
Mn(OH)2 | Fe (OH)3 | Al(OH)3 | |
开始沉淀pH | 7.1 | 2.2 | 4. 1 |
沉淀完全pH | 10.8 | 3.5 | ? |
Al(OH)3沉淀完全的pH为______________{已知Ksp[Al(OH)3]=1×10-33};“调pH”时,应将溶液pH调整的范围是______________________。
(4)“除重金属”时,发生反应Hg2++MnS![]() HgS+M2+,其平衡常数K=___________[已知溶度积常数Ksp(HgS)=1.6×10-52,Ksp(MnS)=2.5×10-10,答案保留三位有效数学]。
HgS+M2+,其平衡常数K=___________[已知溶度积常数Ksp(HgS)=1.6×10-52,Ksp(MnS)=2.5×10-10,答案保留三位有效数学]。
(5)“步骤X”包含的操作有蒸发浓缩、__________、洗涤、干燥等。