题目内容
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________;M在元素周期表中的位置为____________;
⑵ Z、X两元素按原子数目比2∶4构成分子则其结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下:
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
其中表示生成1 mol硒化氢反应热的是__________(填字母代号)。
(1)O 第三周第ⅢA族 (2) 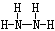 (3) (3) H2SeO4 b
(3) (3) H2SeO4 b
解析试题分析:M是地壳中含量最高的金属元素,所以M是Al,X、Y、Z、L是组成蛋白质的基础元素,且X、Y、Z、L、M五种元素的原子序数依次增大,所以X、Y、Z、L分别是H、C、N、O.(1)L的元素符号为O,Al位于周期表中第3周期,第ⅢA族。(2)N和H两元素按原子数目比2:4构成分子N2H4,由共价键构成的共价化合物,N2H4的结构式为: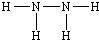 。(3)Se与O同一主族,Se原子比O原子多两个电子层,即电荷数多26,则Se的原子序数为34,其最高价氧化物对应的水化物化学式为H2SeO4,故答案为:;H2SeO4.根据元素的非金属性越强其气态氢化物越稳定,与氢气化合放出的热量越多,硒是排在第三位,故其中表示生成1 mol硒化氢反应热的是 b.+29.7 mol·L-1。
。(3)Se与O同一主族,Se原子比O原子多两个电子层,即电荷数多26,则Se的原子序数为34,其最高价氧化物对应的水化物化学式为H2SeO4,故答案为:;H2SeO4.根据元素的非金属性越强其气态氢化物越稳定,与氢气化合放出的热量越多,硒是排在第三位,故其中表示生成1 mol硒化氢反应热的是 b.+29.7 mol·L-1。
考点:本题是一道关于元素周期表和元素周期律知识的综合题目,考查角度广,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| | 原子或分子相关信息 | 单质及其化合物相关信息 |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的1/2 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W在周期表的位置为 ,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为 。
(2)X的简单阴离子的结构示意图为 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(3)Z的氧化物在通讯领域用来作 ,工业上制备Z的单质的化学反应方程式为 。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为 。
(4)在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积可能 种情况(填一或二)。
X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| | 原子或分子相关信息 | 单质及其化合物相关信息 |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的1/2 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(2)X的简单阴离子的结构示意图为 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(3)Z的氧化物在通讯领域用来作 ,工业上制备Z的单质的化学反应方程式为 。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为 。
(4)在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积最多为 mL。
β型硼氮化合物—-(BN)n是一种无机合成材料[最简式为(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料。用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得。例如: Na2B4O7 + 2CO(NH2)2 → 4(BN) + Na2O + 2CO2
(1)请用氧化物的形式表示硼砂的化学式 。β型(BN)n比晶体硅具有更高硬度和耐热性的原因是: 。
(21)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于第 周期,第 族。
(3)能用于比较N与O非金属性相对强弱的事实是 。
| A.最高价氧化物对应水化物的酸性 | B.H2O(g) 比NH3(g)稳定 |
| C.单质与H2反应的难易程度 | D.NO中氮元素显正价,氧元素显负价 |
(5)与硼同主族且相邻周期的元素,其最高价氧化物与NaOH溶液反应的离子方程式 为: 。
A、B、C、D、E五种短周期元素,原子序数依次增大,有关信息如下。
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质既可与盐酸反应,又可与NaOH溶液反应 |
| E | 原子最外层电子数比次外层电子数少1个 |
请回答下列问题:
(1)A的氢化物的水溶液能使酚酞试液变红,原因是(用电离方程式表示),实验室制取该氢化物的化学方程式是 。
(2)A与B可组成质量比为7∶16的三原子分子,下列环境问题与该物质的排放有关的是(填序号)。
①酸雨 ②温室效应 ③臭氧层破坏 ④光化学污染
(3)C的最高价氧化物的水化物与E单质反应可用于生产消毒液,其离子方程式是 。
(4)D在元素周期表中的位置是。由元素A、D组成某化合物,具有良好电绝缘性,该物质与水缓慢反应的化学方程式是 。
X、Y、Z、T、W五种元素的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是______;W元素基态原子电子排布式
为______________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是___________________。
A.常温下Z的单质和T的单质状态不同
B. T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D. T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的σ键与π键个数比为______,它所形成的晶体类型为______; Y的常见氢化物易液化的主要原因是________________________。
(4)元素X与钙元素可以形成一种离子化合物,该化合物的阴离子和CO互为等电子体,该化合物的电子式为 ;其中元素X的杂化类型是 。
 HCNO + NH3(已配平)。完成下列填空:
HCNO + NH3(已配平)。完成下列填空: 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)