题目内容
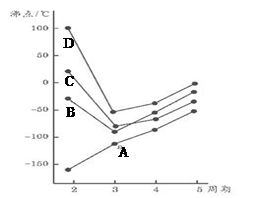
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知Y、Z的单质是空气的主要成分,W的原子半径在同周期中最小。请回答下列问题: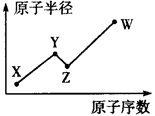
(1)写出化合物XWZ的电子式:_______________________。
(2)由W、Y两种元素组成的一种化合物M分子中,每个原子最外层均达到稀有气体的稳定结构,在工业生产中M大规模用于面粉的漂白和杀菌,写出M与水反应的化学方程式:________________。
(3)由W、X、Y、Z四种元素中的三种元素组成的某种化合物N是一种常见的化肥,若N能促进水的电离,则其化学式为____________________;若N能抑制水的电离,则其化学式为___________________。
(4)XYZ3溶液的酸性比XWZ溶液的酸性强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:________________________________。
(1)XWZ的电子式为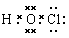 (2分)
(2分)
(2)NCl3+3H2O=3HClO+NH3(或NCl3+4H2O=3HClO+NH3·H2O)(2分)
(3)NH4NO3(或NH4Cl)(1分);NH3·H2O(1分)
(4)不正确;HClO不是Cl的最高价氧化物对应的水化物(2分)
解析试题分析:有题意可知Y为N,Z为O,由原子序数:X<Y,原子半径:X<Y,故X为H。由原子序数:Z<W,原子半径:Z<W,且W的原子半径是同周期中最小。故W是Cl。(1)XWZ的电子式为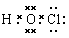 ,(2)由题意可知M为NCl3,其与水反应应生成HClO,故方程式为:NCl3+3H2O=3HClO+NH3(或NCl3+4H2O=3HClO+NH3·H2O);(3)化合物N由三种元素组成的常见化肥,故应含有N,能促进水解的应为铵盐,为NH4NO3或NH4Cl;能抑制水解的应为NH3·H2O。(4)HClO不是Cl的最高价氧化物对应的水化物,故不正确。
,(2)由题意可知M为NCl3,其与水反应应生成HClO,故方程式为:NCl3+3H2O=3HClO+NH3(或NCl3+4H2O=3HClO+NH3·H2O);(3)化合物N由三种元素组成的常见化肥,故应含有N,能促进水解的应为铵盐,为NH4NO3或NH4Cl;能抑制水解的应为NH3·H2O。(4)HClO不是Cl的最高价氧化物对应的水化物,故不正确。
考点:考查原子结构、化学用语、化合物的性质等知识点。

现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | 最外层电子数是内层电子数的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(2)化合物A的溶液呈碱性,用离子方程式解释其原因: ,该化合物起消毒作用的微粒是 。
(3)将Y与Z形成的化合物的水溶液逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴边振荡),写出此过程中发生反应的离子方程式
、 。
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,
回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | ⑨ | ⑥ | ⑦ | | | ⑧ | |
(1)由①、②两种元素组成的相对分子质量为28的有机物的空间构型是 ,
该物质与溴水发生加成反应的化学方程式是 。
(2)用电子式表示④的简单氢化物的形成过程如下: ;
(3) 请设计实验比较元素⑥与⑨金属性的相对强弱: _;
(4) 用①元素的单质与④元素的单质可以制成电池,电池中装有KOH浓溶液,将多孔的惰性电极甲和乙浸入KOH溶液中,在甲极通入①的单质,乙极通入④的单质,则甲极的电极反应式为: 。
(5)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生以下反应:
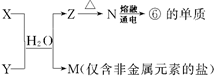
X溶液与Y溶液反应的离子方程式为 ,工业上常用单质⑥冶炼难熔的金属,写出氧化铁和单质⑥在高温下反应的化学方程式 。

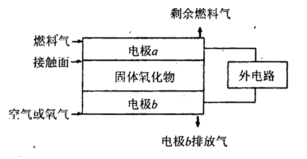
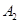 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。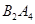 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。
