题目内容
15.T℃时,向2.0L恒容密闭容器中充入1.0molPCl5,发生下列反应:PCl5(g)?PCl3(g)+Cl2(g).经过一段时间达到平衡,反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| N(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | T℃时,该反应的平衡常数K=0.05mol•L-1 | |
| B. | 0-50s内反应的平均反应速率v(Cl2)=0.0032mol•L-1•s-1 | |
| C. | 其他条件不变,升高温度,平衡时c(PCl3)=0.12mol•L-1,则该反应的△H<0 | |
| D. | T℃时,若起始充入1.0molPCl5、0.2molPCl3和0.2molCl2,则起始时v(正)>v(逆) |
分析 A、结合平衡三段式列式计算平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
B、由表中数据可知50s内,△n(PCl3)=0.16mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(PCl3),速率之比等于化学方程式计量数之比;
C、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol,根据平衡时n(PCl3),判断平衡移动方向,升高温度平衡向吸热反应方向移动;
D、先求平衡常数K,再求浓度商(Qc),K>Qc,说明平衡向正反应方向移动,K<Qc,说明平衡向逆反应方向移动,K=Qc,说明平衡不移动,据此判断平衡移动.
解答 解:A、对于可逆反应:PCl5(g)?PCl3(g)+Cl2(g),
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
所以平衡常数k=$\frac{0.1×0.1}{0.4}$=0.025,故A错误;
B、由表中数据可知50s内,△n(PCl3)=0.16mol,v(PCl3)=$\frac{\frac{0.16mol}{2L}}{50s}$=0.0016mol/(L•s),速率之比等于化学方程式计量数之比,0-50s内反应的平均反应速率v(Cl2)=v(PCl3)=0.0032mol•L-1•s-1 ,故B正确;
C、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.112mol/L,则n′(PCl3)=0.12 mol/L×2L=0.24mol,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,故C错误;
D、对于可逆反应:PCl5(g)?PCl3(g)+Cl2(g),
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
所以平衡常数k=$\frac{0.1×0.1}{0.4}$=0.025;
起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=$\frac{0.1×0.1}{0.5}$=0.02,Qc<K,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故D正确;
故选BD.
点评 本题考查反应速率、平衡常数计算、平衡移动、等效平衡等,难度中等,注意平衡计算的方法应用.

 名校课堂系列答案
名校课堂系列答案| A. | 往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 | |
| B. | 氢氧化镁分解时吸收大量热量,可添加到合成树脂中做阻燃剂 | |
| C. | 酒精能使蛋白质变性,无水酒精在医学上常被用于消毒 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
| A. | HCl分子中的共价键是由H原子的1s轨道和Cl原子未成对电子的3p轨道形成的s-pσ键 | |
| B. | 石墨晶体中碳原子的杂化轨道类型为sp2,碳原子间只存在sp2-sp2σ键 | |
| C. | H2O分子中的共价键是由O原子的sp3杂化轨道和H原子的s轨道形成的s-sp3σ键 | |
| D. | N2分子中的共价键是由2个N原子各自用3个p轨道形成的3个p-pπ键 |
| A. | NaCl | B. | NaCl和NaBr | C. | NaBr | D. | 无法确定 |
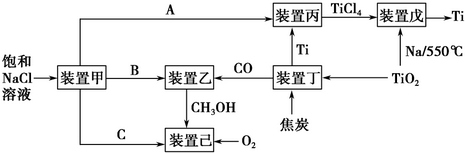
请回答下列问题:
(1)装置甲为电解池(惰性电极),根据图示转化关系可知:A为Cl2(填化学式),阴极反应式为2H++2e-=H2↑.
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净
装置戊进行反应时需要的环境为C(填字母序号).
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
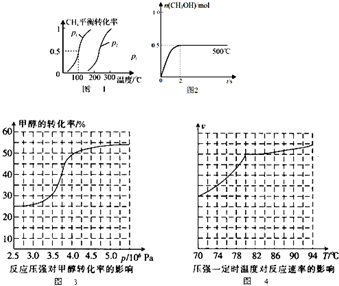
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
A使用催化剂 B降低温度C增加H2的浓度
(4)装置己可以看作燃料电池,该燃料电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O.