题目内容
5.根据周期表对角线法则,金属Be和Al单质及化合物性质相似,又知AlCl3的熔沸点低,容易升华.试回答:(1)写出Be和氢氧化钠反应的化学方程式Be+2NaOH=Na2BeO2+H2↑.
(2)Be(OH)2和Mg(OH)2可以用NaOH溶液试剂鉴别,其离子方程式为Be(OH)2+2OH-=BeO22-+2H2O.
(3)BeCl2是共价(填离子或共价)化合物.
(4)Li和Mg根据对角线法则,性质也相似,Li在空气中燃烧,主要产物的化学式为Li2O.
分析 (1)元素周期表中,处于对角线位置的元素具有相似的性质,则根据铝的单质的性质可推断铍与氢氧化钠的反应;
(2)氢氧化铍与氢氧化铝性质相似,能和氢氧化钠反应,而Mg(OH)2和氢氧化钠不反应;
(3)氯化铍与氯化铝相似,均为共价化合物;
(4)Li与Mg根据对角线规则,性质也相似,而Mg与空气中的氧气、氮气反应,主要生成MgO,还有少量Mg3N2生成,则Li在空气中燃烧,主要生成氧化锂.
解答 解:(1)金属铍与铝的单质及其化合物性质相似,则Be与NaOH溶液反应生成Na2BeO2和氢气,离子反应为Be+2NaOH=Na2BeO2+H2↑,故答案为:Be+2NaOH=Na2BeO2+H2↑;
(2)氢氧化铍与氢氧化铝性质相似,能和氢氧化钠反应,而Mg(OH)2和氢氧化钠不反应,则选NaOH溶液鉴别,离子反应为Be(OH)2+2OH-=BeO22-+2H2O,
故答案为:NaOH溶液;Be(OH)2+2OH-=BeO22-+2H2O;
(3)氯化铍与氯化铝相似,均为共价化合物,故答案为:共价;
(4)Li与Mg根据对角线规则,性质也相似,而Mg与空气中的氧气、氮气反应,主要生成MgO,还有少量Mg3N2生成,则Li在空气中燃烧,主要生成Li2O,还生成少量的Li3N,故答案为:Li2O.
点评 本题考查元素周期表及应用,为高频考点,侧重学生分析能力及知识迁移应用能力的考查,注意利用已知物质的性质进行类别解答,注意物质的相似之处和不同之处,难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
15.T℃时,向2.0L恒容密闭容器中充入1.0molPCl5,发生下列反应:PCl5(g)?PCl3(g)+Cl2(g).经过一段时间达到平衡,反应过程中测定的部分数据见下表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| N(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | T℃时,该反应的平衡常数K=0.05mol•L-1 | |
| B. | 0-50s内反应的平均反应速率v(Cl2)=0.0032mol•L-1•s-1 | |
| C. | 其他条件不变,升高温度,平衡时c(PCl3)=0.12mol•L-1,则该反应的△H<0 | |
| D. | T℃时,若起始充入1.0molPCl5、0.2molPCl3和0.2molCl2,则起始时v(正)>v(逆) |
16.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入128gSO2和32gO2充分反应,最终放出的热量为( )
| A. | <98.32kJ | B. | >98.32kJ/mol | C. | <196.64kJ | D. | >196.64kJ |
13.工业上,为使95.6%的乙醇变为100%的绝对乙醇,常常加入一种物质加热回流一段时间后蒸馏,得到99.5%的无水乙醇,这种物质是( )
| A. | 无水硫酸 | B. | 无水氯化钙 | C. | 生石灰 | D. | 浓硫酸 |
20.下列叙述正确的是( )
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物,只要是离子化合物,其熔点就比共价化合物的熔点高
④难失去电子的原子,易形成阴离子
⑤单质分子中不存在化学键,化合物的分子中才存在化学键
⑥离子化合物中一定含有离子键.
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物,只要是离子化合物,其熔点就比共价化合物的熔点高
④难失去电子的原子,易形成阴离子
⑤单质分子中不存在化学键,化合物的分子中才存在化学键
⑥离子化合物中一定含有离子键.
| A. | 只有②⑥ | B. | 只有①⑥ | C. | 只有⑥ | D. | 只有①④⑥ |
10.有一多肽其化学式为C55H70O19N10,将其彻底水解后只得到下列四种氨基酸:
甘氨酸(H2N-CH2COOH),丙氨酸(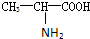 ),苯丙氨酸(
),苯丙氨酸(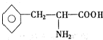 )
)
谷氨酸(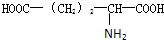 ),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
甘氨酸(H2N-CH2COOH),丙氨酸(
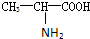 ),苯丙氨酸(
),苯丙氨酸( )
)谷氨酸(
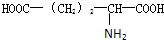 ),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )| A. | 10,4,3 | B. | 10,3,4 | C. | 9,4,3 | D. | 9,3,4 |
14.R的气态氢化物为RH3,则R元素最高价氧化物的水化物的化学式可能是( )
| A. | H3RO4 | B. | H2RO4 | C. | HRO4 | D. | H2RO3 |
15.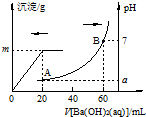 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A. | 图中A点对应溶液的pH:a=1 | |
| B. | 生成沉淀的最大质量m=2.33g | |
| C. | 原混合液中c(HCl)=0.1mol•L-1 | |
| D. | 当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
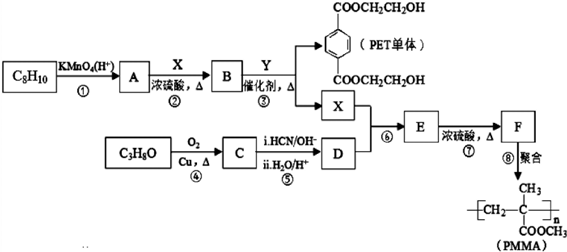
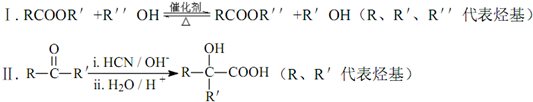
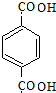 .
.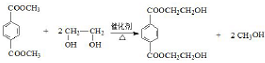 .
.