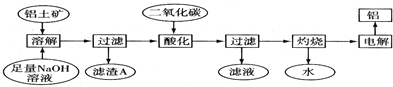
题目内容
3.把Cl2通入含22g NaBr的溶液中,反应后加热,烘干得到固体13.1g,则此固体成分为( )| A. | NaCl | B. | NaCl和NaBr | C. | NaBr | D. | 无法确定 |
分析 根据方程式Cl2+2NaBr=2NaCl+Br2,所以一定含有氯化钠,通过氯气与溴化钠反应来定量分析是否溴化钠过量,综合分析解答.
解答 解:设参加反应的氯气的质量为m1,参加反应的溴化钠为a,
Cl2+2NaBr=2NaCl+Br2 质量差
71 206 117 160 89
m1 a 22-13.1=8.9g
$\frac{71}{m1}=\frac{89}{8.9}$=$\frac{206}{a}$,
解得m1=7.1g,a=20.6g
因为22g>20.6g,所以溴化钠过量,所以得到的固体物质为NaCl和NaBr,故选B.
点评 本题考查化学方程式的相关计算,来确定溴化钠是否过量,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
9.进行化学实验时必须注意安全,下列选项正确的是( )
| A. |  点燃酒精灯 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 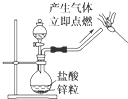 制备氢气并检验H2的可燃性 | |
| D. | 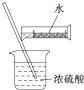 配制硫酸溶液 |
10.以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可; ②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,再加入足量的氢氧化镁,充分反应,过滤结晶即可; ③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,再加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe3+、Fe2+ 都被转化为Fe(OH)3(填名称)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+时所发生的总反应的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
(1)上述三个除杂方案都能够达到很好的效果,Fe3+、Fe2+ 都被转化为Fe(OH)3(填名称)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+时所发生的总反应的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
7.下列各组物质中化学键类型不相同的是( )
| A. | NaCl和HNO3 | B. | H2O和NH3 | C. | CaCl2和NaCl | D. | H2S和Na2S |
14.某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在a g HmX中所含质子的物质的量是( )
| A. | a×(A-N+m)/(A+m)mol | B. | a×(A-N)/Amol | C. | a×(A-N)/(A+m)mol | D. | a×(A-N+m)/Amol |
15.T℃时,向2.0L恒容密闭容器中充入1.0molPCl5,发生下列反应:PCl5(g)?PCl3(g)+Cl2(g).经过一段时间达到平衡,反应过程中测定的部分数据见下表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| N(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | T℃时,该反应的平衡常数K=0.05mol•L-1 | |
| B. | 0-50s内反应的平均反应速率v(Cl2)=0.0032mol•L-1•s-1 | |
| C. | 其他条件不变,升高温度,平衡时c(PCl3)=0.12mol•L-1,则该反应的△H<0 | |
| D. | T℃时,若起始充入1.0molPCl5、0.2molPCl3和0.2molCl2,则起始时v(正)>v(逆) |
12.有八种物质:①甲烷、②苯、③聚乙烯、④丙烯 ⑤2-丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
| A. | ③④⑤ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦⑧ |
13.工业上,为使95.6%的乙醇变为100%的绝对乙醇,常常加入一种物质加热回流一段时间后蒸馏,得到99.5%的无水乙醇,这种物质是( )
| A. | 无水硫酸 | B. | 无水氯化钙 | C. | 生石灰 | D. | 浓硫酸 |