题目内容
7.甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:(i)制备合成气:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.0kJ•mol-1
(ii)合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H2
请回答下列问题:
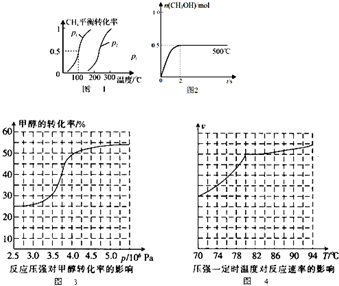
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图1.
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)=0.003mol•L-1min-1.
②图中p1<p2(填“<”、”“>”或“=”).
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g)?CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为3:1.
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图2.
①反应(ii)需在低温(填“高温”或“低温”)才能自发进行.
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是Cu2O+CO?2Cu+CO2(用化学方程式表示)
③在500℃恒压条件下,请在图2中画出反应体系中n(CH3OH)随时间t变化的总趋势图.
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g)?HCOOCH3(g)△H=-29.1kJ•mol-1,科研人员对该反应进行了研究,部分研究结果如下:
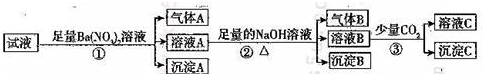
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是4.0×106Pa(填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”).
②实际工业生产中采用的温度是80℃,其理由是低于80℃,反应速率较小;高于80℃时,温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,转化率降低.
分析 (1)①用H2表示的平均反应速率可以根据甲烷的反应速率来求算,根据v=$\frac{△c}{△t}$来计算甲烷的反应速率;
②根据压强对化学平衡移动的影响来回答,反应前后气体体积增大,增大压强,化学平衡逆向移动,甲烷的转化率减小;
③①CH4+H2O(g)?CO+3H2,②CO2+H2=CO+H2O,③CO(g)+2H2(g)?CH3OH(g),则①×3+②+③×4得3CH4+CO2+2H2O=4CH3OH;
(2)①依据反应自发进行的判断依据是△H-T△S<0分析判断;
②在加热条件下CO能还原Cu2O使其减少,因此反应体系中含有少量二氧化有利于抑制反应向正反应方向移动,维持Cu2O的量不变;
③结合影响反应速率和影响平衡移动的因素解答;
(3)①依据转化率曲线分析判断,图象中转化率变化最大的是4.0×106Pa;
②图象分析速率随温度变化的趋势,低于80℃,反应速率较小,高于80℃时,温度对反应速率影响较小,据此分析回答.
解答 解:(1)①根据图象数据,用甲烷表示的平均反应速率v=$\frac{△c}{△t}$=$\frac{0.01mol/L×0.5}{5min}$=0.001mol/(L•min),氢气的反应速率是甲烷化学反应速率的3倍,故用H2表示的平均反应速率为0.0030mol•L-1•min-1,
故答案为:0.0030mol•L-1•min-1;
②根据化学方程式可以得出,反应前后气体体积增大,增大压强,化学平衡逆向移动,甲烷的转化率减小,可以从200℃来分析,发现甲烷的转化率是p1时大于p2时的,所以P1<P2,
故答案为:<;
③CH4+H2O(g)?CO+3H2,②CO2+H2=CO+H2O,③CO(g)+2H2(g)?CH3OH(g),则①×3+②+③×4得3CH4+CO2+2H2O=4CH3OH,所以为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为3:1,
故答案为:3:1;
(2)①合成甲醇:CO(g)+2H2(g)?CH3OH(g),反应前后气体体积减小,△S<0,反应是放热反应,△H<0,满足△H-T△S<0,需要在低温下自发进行;
故答案为:低温;
②在加热条件下CO能还原Cu2O使其减少,因此反应体系中含有少量二氧化有利于抑制反应向正反应方向移动,维持Cu2O的量不变,反应方程式为Cu2O+CO?2Cu+CO2,
故答案为:Cu2O+CO?2Cu+CO2;
③合成甲醇:CO(g)+2H2(g)?CH3OH(g),反应前后气体体积减小,在500℃恒压条件下,容器体积减小压强增大,相当于增大了压强,达到平衡时,画出达平衡时间小于2s,由于平衡正向进行,所以画出甲醇物质的量平衡时纵坐标高于恒容条件下甲醇物质的量得到图象为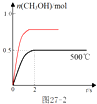 ;
;
故答案为: ;
;
(3)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是4.0×106Pa,故答案为:4.0×106Pa;
②依据图象分析,低于80℃,反应速率较小,温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:低于80℃,反应速率较小,高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低.
点评 本题考查反应速率概念计算,平衡标志的判断,影响化学平衡、反应速率因素和图象的分析,注意掌握基础知识的掌握,题目难度中等.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案| A. | a×(A-N+m)/(A+m)mol | B. | a×(A-N)/Amol | C. | a×(A-N)/(A+m)mol | D. | a×(A-N+m)/Amol |
| t/s | 0 | 50 | 150 | 250 | 350 |
| N(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | T℃时,该反应的平衡常数K=0.05mol•L-1 | |
| B. | 0-50s内反应的平均反应速率v(Cl2)=0.0032mol•L-1•s-1 | |
| C. | 其他条件不变,升高温度,平衡时c(PCl3)=0.12mol•L-1,则该反应的△H<0 | |
| D. | T℃时,若起始充入1.0molPCl5、0.2molPCl3和0.2molCl2,则起始时v(正)>v(逆) |
下列有关判断正确的是( )
| A. | 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 原溶液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
| A. | ③④⑤ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦⑧ |
| A. | Na2O2的电子式为 | |
| B. | 16g甲烷完全燃烧生成的CO2为11.2L(标准状况) | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为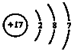 |
| A. | <98.32kJ | B. | >98.32kJ/mol | C. | <196.64kJ | D. | >196.64kJ |

 .
. .
.