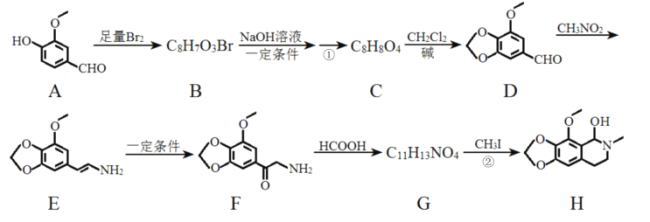
��Ŀ����
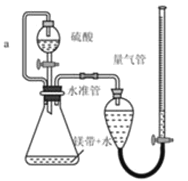
����Ŀ������ͼ��ʾװ�òⶨþ����Ʒ�е��ʵ������������������ᷴӦ���������壩�����������գ�
��1�������ӷ���ʽ��ʾ��ʵ��ķ�Ӧԭ����____________��
��2������þ������Ķ��������� _______________��
��3��������������Ŀ����_____________��
��4������a�������� ____________ ��
��5������ⶨ���ƫ�ߣ����ܵ�ԭ����____________����ѡ���ţ�
a װ��©�� b δ��ȴ�����¼�����
c þ���к�������þ dδ����ʱ�����ܵ�Һ�����ˮ��
���𰸡�Mg+2H+![]() Mg2++H2
Mg2++H2![]() ������ƽ ʹþ����ȫ��Ӧ ʹ����˳�����£�����������Һ�����������IJⶨ����Ӱ�� bd
������ƽ ʹþ����ȫ��Ӧ ʹ����˳�����£�����������Һ�����������IJⶨ����Ӱ�� bd
��������
(1)þ��ϡ���ᷴӦ��������þ��������
(2)����þ��������������Ҫ֪����Ʒ��������
(3)ʵ������Ҫͨ�����������ʵ������þ�����������Լ������������أ�ȷ��Mg��ȫ��Ӧ��
(4)����a��ƽ����ѹ��ʹ��Һ©���е�����˳�����£�
(5)ͨ�����������ʵ������þ���������Ӷ������Ʒ��þ���������������ⶨ���������ƫС����ⶨ���ƫ�ͣ����ⶨ���������ƫ�ߣ���ⶨ���ƫ�ߣ��ݴ˽��з�����
(1)þ��ϡ���ᷴӦ��������þ����������Ӧ�����ӷ�Ӧ����ʽΪ��Mg+2H+= Mg2++ H2����
(2)ʵ���вⶨþ����Ʒ�е���þ��������������Ҫ��ȷ����þ������������������Ķ�������������ƽ��
(3)ʵ������Ҫͨ�����������ʵ������þ���������Ӷ������Ʒ��þ���������������Լ����������������ȷ��Mg��ȫ��Ӧ��
(4)�淴Ӧ�Ľ��У���ƿ���������࣬ѹǿ����Һ©���е�����������£�Ϊ��ƽ����ѹ���õ���a����Һ©������ƿ�����������Ϳ���ʹ����˳�����£����Ե���a��������ƽ����ѹ��ʹ����˳�����£�
(5)a��װ��©�����������������С���ⶨ���ƫ�ͣ���a����
b��δ��ȴ�����¼�������������������ԭ����֪���ⶨ���������ƫ�ⶨ���ƫ�ߣ���b��ȷ��
c��þ���к�������þ���������������ƫС���ⶨ���ƫ�ͣ���c����
d��ĩ����ʱ�����ܵ�Һ�����ˮ�ܣ����¶������ƫ�ⶨ���ƫ�ߣ���d��ȷ��
�ʴ�Ϊ��bd��

����Ŀ�������£�������ĵ���ƽ�ⳣ�����£�
��ѧʽ | HF | HCN | H2CO3 |
���볣�� | Ka��3.5��10��4 | Ka��5.0��10��10 | Ka1��4.3��10��7�� Ka2��5.6��10��11 |
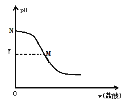
��1��c(H+)��ͬ�������ᣬ�����Ũ�ȴӴ�СΪ________________��
��2��0.0lmol/L��HCN��Һ�У�c(H+)ԼΪ_____mol/L��ʹ����Һ��HCN�ĵ���̶�������c(H+)Ҳ����ķ�����_______________________��
��3���к͵�����NaOH�����ĵ�pH�����������������ֱ�ΪaL��bL����a_____b������ڡ�����С�ڡ����ڡ�����ͬ��b���к͵�Ũ�ȡ��������������������ҪNaOH�����ʵ���Ϊn1��n2����n1_____n2��
��4����NaCN��ͨ��������CO2�����������ӷ���ʽΪ_______________��
��5�����ʵ��֤�������������������__________________��