题目内容
【题目】根据下列图示所得出的结论正确的是

A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
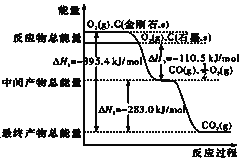
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
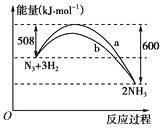
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
【答案】B
【解析】
A.2A(g)+2B(g)3C(g)+D(s)为气体体积减小的反应,增大压强平衡正向移动,图中平衡状态相同,应为使用催化剂,故A错误;
B.图中金刚石比石墨的能量高,则石墨转化为金刚石的反应的△H>0,故B正确;
C.增大氢气的量,可促进氮气的转化率,则图中a点N2的转化率小于b点,故C错误;
D.开始的pH相同,稀释相同倍数时,酸性强的pH变化大,则HA的酸性强,相同条件下NaA溶液的pH小于同浓度的NaB溶液的pH,故D错误;
故答案为B。

【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) △H2=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=___________。
(2)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol/L,则此时v正____v逆(填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图所示,表示c(N2)—t的曲线是______。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。

(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
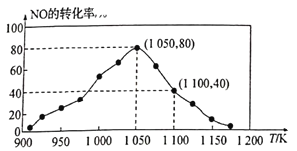
①由图可知,在1100K时,CO2的体积分数为__________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=______[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
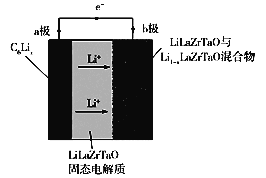
(4)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯![]() 原理如图所示
原理如图所示
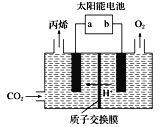
①太阳能电池的负极是_______(填“a”或“b”)
②生成丙烯的电极反应式是___________。