题目内容
【题目】乙酸乙酯广泛存在于药物、染料、香料等工业,中学化学实验常用装置来制备:
完成下列填空:
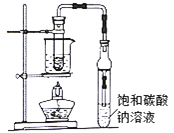
(1)写出实验室制备乙酸乙酯的化学方程式:_______通常加入过量乙醇,原因是_______
(2)饱和碳酸钠溶液的作用是①__________②__________
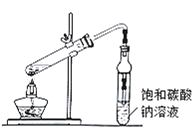
(3)若用装置制备乙酸乙酯,其缺点有_________、_________。边反应边通过分液漏斗边滴加乙酸,边加热蒸出乙酸乙酯。这样操作可以提高酯的产率。其原因是______
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物。下列框图是分离操作步骤流程图:
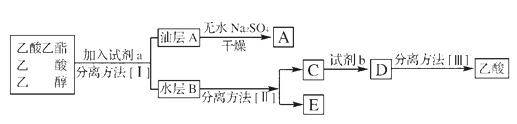
分离方法II是____________试剂b是____________。
【答案】CH3COOH+HOCH2CH3![]() CH3COOCH2CH3+H2O 增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率 中和乙酸、溶解乙醇 减少乙酸乙酯在水中的溶解 原料损失较大 易发生副反应 提高乙酸的转化率 蒸馏 硫酸
CH3COOCH2CH3+H2O 增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率 中和乙酸、溶解乙醇 减少乙酸乙酯在水中的溶解 原料损失较大 易发生副反应 提高乙酸的转化率 蒸馏 硫酸
【解析】
实验室制取乙酸乙酯时依次在试管中加入乙醇、浓硫酸、醋酸,在水浴加热条件下进行反应,在盛有饱和碳酸钠溶液的试管中进行收集;
(4)乙酸乙酯、乙酸和乙醇的混合物中加入饱和碳酸钠溶液,乙酸和乙醇均溶于饱和碳酸钠溶液,乙酸乙酯不溶,所以溶液分层,分液得到油层和水层,油层主要为乙酸乙酯,干燥后得到乙酸乙酯;对水层进行蒸馏得到乙醇和乙酸钠溶液,对乙酸钠溶液加入硫酸酸化再蒸馏得到乙酸。
(1)实验室制备乙酸乙酯的方程式为CH3COOH+HOCH2CH3![]() CH3COOCH2CH3+H2O;加入过量乙醇可以提高反应物浓度使平衡右移,产率增大,同时可以提高乙酸的转化率;
CH3COOCH2CH3+H2O;加入过量乙醇可以提高反应物浓度使平衡右移,产率增大,同时可以提高乙酸的转化率;
(2)由于生成的乙酸乙酯中含有乙醇和乙酸,所以饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解;
(3)该装置由于不是水浴加热,温度不易控制,因此制备乙酸乙酯的缺点有原料损失较大、易发生副反应;边反应边通过分液漏斗边滴加乙酸,边加热蒸出乙酸乙酯可以使平衡右移提高乙酸的转化率和乙酸乙酯的产率;
(4)根据分析可知分离方法II是蒸馏;试剂b是硫酸。