题目内容
14.A、B两容器极易导热,A容器的容积不变,B容器有一个可以上下滑动的活塞,以保持内外压强相等.在相同条件下,将等量的NO2分别压入容积相同的A、B两容器中,反应为:2NO2(g)?N2O4(g)△H<0,下列叙述不正确的是( )| A. | 反应起始时,两容器中生成N2O4的速率关系是v(A)=v(B) | |
| B. | 反应达到平衡前,两容器中生成N2O4的速率关系是v(A)<v(B) | |
| C. | 反应达到平衡后,NO2的转化率大小关系是v(A)<v(B) | |
| D. | 两容器均达到平衡后,再分别充入等量的氮气,发生平衡移动的是B容器,且平衡移动后,NO2的转化率将增大 |
分析 A、反应起始时,两容器中NO2的浓度相等;
B、因为该反应是体积减小的反应,B是恒压,而A是恒容,所以在反应过程中B的压强大于A,压强大反应速率也大,据此判断;
C、因为该反应是体积减小的反应,B是恒压,而A是恒容,所以在达到平衡时,B的压强大于A,B容器中反应正向进行的程度大于A,所以NO2的转化率大小关系是:A<B;
D、两容器均达到平衡后,再分别充入等量的氮气,B是恒压,相当于减小反应体系的压强,平衡向逆方向移动,A是恒容,平衡不移动,据此判断.
解答 :A、反应起始时,两容器中NO2的浓度相等,所以两容器中生成N2O4的速率关系是v(A)=v(B),故A正确;
B、因为该反应是体积减小的反应,B是恒压,而A是恒容,所以在反应过程中B的压强大于A,压强大反应速率也大,所以生成N2O4的速率关系是v(A)<v(B),故B正确;
C、因为该反应是体积减小的反应,B是恒压,而A是恒容,所以在达到平衡时,B的压强大于A,B容器中反应正向进行的程度大于A,所以NO2的转化率大小关系是:A<B,故C正确;
D、两容器均达到平衡后,再分别充入等量的氮气,B是恒压,相当于减小反应体系的压强,平衡向逆方向移动即NO2的转化率将减小,A是恒容,平衡不移动,故D错误;
故选D.
点评 本题主要考查了影响化学平衡移动的因素等知识点,难度不大,解的关键是要注意两容器一个是恒容一个恒压的区别.

练习册系列答案
相关题目
5.2007年度诺贝尔化学奖,授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德•艾特尔,表彰他在“固体表面化学过程”研究中作出的贡献.下列说法正确的是( )
| A. | 使用催化剂,能增大氢气的转化率 | |
| B. | 增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 | |
| C. | 采用正向催化剂时,反应的活化能降低,使反应明显加快 | |
| D. | 工业生产中,合成氨采用的压强越高,温度越低,越有利于提高经济效益 |
2.芳香族化合物M的结构如图所示,下列叙述正确的是( )
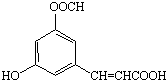

| A. | M有3种不同的官能团 | |
| B. | M可发生取代、加成、消去和聚合等4种有机反应 | |
| C. | 1molM完全燃烧生成CO2和H2O,需要5molO2 | |
| D. | 1molM与足量的NaOH溶液反应,最多需要4molNaOH |
9.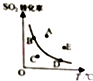 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )| A. | A点 | B. | B、D两点 | C. | C点 | D. | A、E两点 |
3.如图装置的电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
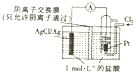

| A. | 正极反应式为Ag-e-=Ag+ | |
| B. | 放电时,溶液中的Cl-向负极移动 | |
| C. | 通入Cl2的一极为负极 | |
| D. | 当电路中转移0.01mole-时,消耗Ag的质量为2.16g |
4.设NA是阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离总数是3 NA | |
| C. | 常温常压下,8 g SO3所含的氧原子的数目为0.3NA | |
| D. | 过氧化钠与H2O反应,每生成0.1mol氧气,转移电子的数目为0.2NA |
 现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题:
现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题: .
.