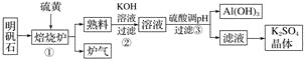
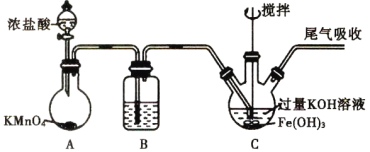
题目内容
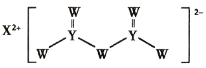
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X是金属元素,W、Y是不同主族的非金属元素且最外层电子数为偶数,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如下图所示。下列叙述正确的是
A.W、X离子半径比较:X>W
B.Y、Z的氢化物稳定性比较:Y>Z
C.1mol YW2晶体中含有4mol Y—W键
D.工业上可通过电解熔融XW来生产X的单质
【答案】C
【解析】
W、Y是不同主族的非金属元素且最外层电子数为偶数,再结合M中W和Y的成键特点可知W应为第ⅥA族元素,Y为第ⅣA族元素;X是金属元素,可形成+2价阳离子,且原子序数大于W,则W为O元素,X为Mg元素,Y为Si元素,Y的原子序数是Z的最外层电子数的2倍,且Z的原子序数大于S,则Z为Cl元素。
A.Mg2+和O2-电子层结构相同,但O2-核电荷数更小,半径更大,即离子半径W>X,故A错误;
B.非金属性越强,氢化物越稳定,非金属性Cl>Si,所以Z的氢化物更稳定,故B错误;
C.YW2为SiO2,为原子晶体,晶体中每个Si原子连接4个Si—O键,所以1molSiO2晶体中含有4molSi—O键,故C正确;
D.MgO的熔点较高,电解MgO制备Mg单质能耗太高,工业上通过电解MgCl2来生成Mg单质,故D错误;
故答案为C。

【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |