题目内容
3.下列说法正确的是( )| A. | 强电解质溶液的导电能力一定大于弱电解质溶液的导电能力 | |
| B. | 溶于水能导电的化合物都是电解质 | |
| C. | 25℃时,0.1mol/L的盐酸中氢离子浓度大于0.1mol/L的醋酸中氢离子浓度 | |
| D. | BaSO4属于强电解质,所以其水溶液导电能力很强 |
分析 A.电解质溶液导电能力与离子浓度成正比;
B.溶于水能导电的化合物不一定是电解质;
C.HCl是强电解质、醋酸是弱电解质,所以HCl在水溶液中完全电离、醋酸部分电离;
D.完全电离的电解质是强电解质,溶液导电能力与离子浓度成正比.
解答 解:A.电解质溶液导电能力与离子浓度成正比,与电解质强弱无关,所以强电解质溶液的导电能力不一定大于弱电解质溶液的导电能力,故A错误;
B.溶于水能导电的化合物不一定是电解质,如二氧化硫等,故B错误;
C.HCl是强电解质、醋酸是弱电解质,所以HCl在水溶液中完全电离、醋酸部分电离,所以相同温度相同浓度时,盐酸溶液导电能力大于醋酸溶液,故C正确;
D.完全电离的电解质是强电解质,溶液导电能力与离子浓度成正比,硫酸钡是强电解质,但在水溶液中溶解度较小,所以其水溶液导电能力较弱,故D错误;
故选C.
点评 本题考查电解质溶液导电性,侧重考查学生分析判断能力,电解质溶液导电性强弱与电解质强弱无关,与溶液中离子浓度有关,为易错题,易错选项是A.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
11.关于铯(Cs)及其化合物的性质,说法错误的是( )
| A. | 金属铯的熔点比金属钠高 | B. | CsOH比NaOH的碱性强 | ||
| C. | Cs与H2O能剧烈反应,甚至发生爆炸 | D. | 碳酸铯易溶于水 |
15.下列关于铷的叙述中正确的是( )
| A. | 硝酸铷是离子化合物 | |
| B. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| C. | 氢氧化铷是弱碱 | |
| D. | 它位于周期表的第四周期、第ⅠA族 |
13.有两种金属的合金10.5克,与足量稀硫酸反应后,产生的气体在标况下占体积11.2L,则组成该合金的元素可能是( )
| A. | Mg和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Na和Zn |
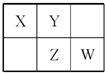 四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍. (写结构式);
(写结构式); ;
;