题目内容
8.Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:(1)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为6s1;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为3:1_.
(2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为Cu3AuH8.
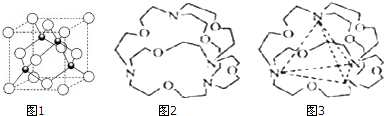
(3)Cu的一种氯化物晶体的晶胞结构如图1所示,该氯化物的化学式是CuCl.
(4)图2表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图3),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别.下列分子或离子中,能被该有机化合物识别的是c(填标号).
a.CF4 b.CH4 c.NH4+ d.H2O.
分析 (1)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,以此判断电子排布式;铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,利用均摊法计算晶胞;
(2)CaF2的结构如图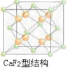 ,利用均摊法计算;
,利用均摊法计算;
(3)由Cu的一种氯化物晶体的晶胞结构可知,Cu位于顶点和面心,Cl位于体内,利用均摊法计算;
(4)嵌入某微粒分别与4个N原子形成4个氢键.
解答 解:(1)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则最外层电子排布式为6s1,在晶胞中Cu原子处于面心,N(Cu)=6×$\frac{1}{2}$=3,Au原子处于顶点位置,N(Au)=8×$\frac{1}{8}$=1,则该合金中Cu原子与Au原子数量之比为3:1,故答案为:6s1;3:1;
(2)CaF2的结构如图 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
故答案为:Cu3AuH8;
(3)由Cu的一种氯化物晶体的晶胞结构可知,Cu位于顶点和面心,N(Cu)=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,Cl位于体内,N(Cl)=4,则化学式为CuCl,故答案为:CuCl;
(4)由氢键的形成条件及成键元素(N、O、F、H)可知,本题中嵌入某微粒分别与4个N原子形成4个氢键,由成键元素及数目可知为NH4+,故答案为:c.
点评 本题考查考查原子结构与性质,为高频考点,综合考查学生的分析能力和基本概念的综合运用能力,侧重分析与计算能力的考查,注意相关基础知识的学习,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
19.最近,复旦大学出现了校园铊投毒案,犯罪嫌疑人日前已被批捕.此前,清华大学也出现过类似的案例.铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
| A. | 铊是易导电的银白色金属 | B. | 能生成+3价离子化合物 | ||
| C. | Tl(OH)3是两性氢氧化物 | D. | Tl3+的氧化能力比Al3+弱 |
16.下列反应中,属于取代反应的是( )
| A. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2↑+NaBr+H2O |
3.下列说法正确的是( )
| A. | 强电解质溶液的导电能力一定大于弱电解质溶液的导电能力 | |
| B. | 溶于水能导电的化合物都是电解质 | |
| C. | 25℃时,0.1mol/L的盐酸中氢离子浓度大于0.1mol/L的醋酸中氢离子浓度 | |
| D. | BaSO4属于强电解质,所以其水溶液导电能力很强 |
13.某粒子含有10个电子,10个中子,电荷为2-,则它的化学符号是( )
| A. | 20Ar | B. | 16O | C. | 18O | D. | 18O2- |
20.下列各组物质,按化合物、单质、混合物的顺序排列的是( )
| A. | 干冰、铁、氯化氢 | B. | 生石灰、白磷、纯碱 | ||
| C. | 烧碱、液态氧、碘酒 | D. | 空气、氮气、胆矾(CuSO4•5H2O) |
17.下列化学用语正确的是( )
| A. | 氮分子的电子式: | B. | 硫原子的结构示意图: | ||
| C. | CO2的电子式: | D. | 水分子的结构式: |
18.下列事实不能作为实验判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 因为酸性HCl>H2S,判断硫、氯的非金属性强弱 | |
| C. | 稳定性CH4<SiH4,判断硅与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |

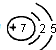 .
.
 元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是
元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是 .
.