题目内容
【题目】某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2 , 并对含量进行测定. 
(1)仪器A的名称是 .
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 .
(3)除去C中过量的H2O2 , 然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 .
(4)若滴定终点时溶液的pH=8.8,则选择的指示剂为 .
(5)该测定结果往往比实际值偏高,分析是由于采用试剂不当引起的,可能的原因为 .
【答案】
(1)冷凝管或冷凝器
(2)SO2+H2O2=H2SO4
(3)③
(4)酚酞
(5)盐酸易挥发
【解析】解:(1)根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b,
故答案为:冷凝管或冷凝器;(2)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法,
故答案为:③;(4)滴定终点时溶液的pH=8.8,应该选择酚酞做指示剂(酚酞的变色范围是8.2~10.0);
故答案为:酚酞;(5)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响,
故答案为:盐酸易挥发.
(1)根据仪器A特点书写其名称;(2)二氧化硫具有还原性,能够与实验室反应生成硫酸,据此写出反应的化学方程式; (3)氢氧化钠应该盛放在碱式滴定管中,根据碱式滴定管的排气泡法进行判断;(4)根据滴定终点时溶液的pH及常见指示剂的变色范围选用正确的指示剂;(5)根据盐酸是挥发性酸,挥发的酸消耗氢氧化钠判断对测定结果的影响;可以选用非挥发性的酸或用蒸馏水代替葡萄酒进行对比实验,减去盐酸挥发的影响.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案【题目】三氯化氧磷(POCl3)常用作半导体掺杂剂,实验室制取POCl3并测定产品质量的实验过程如下,据此回答下列问题:
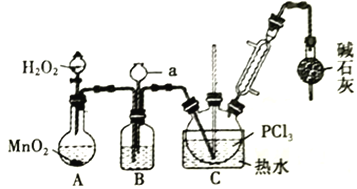
Ⅰ.氧化液态PCl3法制备POCl3:
资料i:有关试剂的性质及实验装置(加热及夹持装置省略)如下:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者均为无色液体,相互溶解;遇水均剧烈水解为两种酸。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)A 中反应时,MnO2的作用是_________________;仪器a的名称为_________________;
(2)盛有浓硫酸的装置B,其作用除观察O2的流速之外,还有_________________;
(3)实验时应控制反应温度在60~65℃,温度不宜过高的原因是_________________;;如果撤去装有碱石灰的干燥管,则可能降低POCl3的产量,原因是_________________________________(用化学方程式表示,任写一个)。
Ⅱ.沉淀滴定法测定POCl3质量:
资料ii :Ag3PO4为黄色沉淀,易溶于硝酸;
iii:Ag++SCN-=AgSCN↓,且Ksp(AgSCN) <Ksp(AgCl)。
实验步骤如下:
①将三颈烧瓶中的产品POCl3去除杂质,溶于60.00mL蒸馏水中,搅拌使其完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.8mol/L AgNO3标准溶液;
③加入少量硝基苯,用力摇动,使沉淀表面覆盖硝基苯;
④加入2~3 滴硫酸铁溶液作指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去10,00mL KSCN溶液。
(4)达到终点时的现象是______________________________;
(5)所得产品POCl3的质量为____________(结果保留两位小数);若取消步骤③,则所得结果将______________(填“ 偏高”、“ 偏低”或“不变”)。
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10﹣5 | K1=4.3×10﹣7 | K1=9.1×10﹣8 | K1=7.5×10﹣3 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸, ![]() 增大
增大
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
【题目】某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为 . 实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01molL﹣1、0.001molL﹣1 , 每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1molL﹣1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液 | 溶液褪色所需时间t/min | ||
第1次 | 第2次 | 第3次 | |
0.01 | 14 | 13 | 11 |
0.001 | 6 | 7 | 7 |
(2)计算用0.001molL﹣1KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行? . (填“行”或“不行”)


