ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΑ¥“Σ«σΜΊ¥πœ¬Ν–Έ ΧβΘΚ IΘ°ΫΪΒ»Έο÷ ΒΡΝΩΒΡAΓΔBΜλΚœΖ≈”Ύ2LΒΡΟή±’»ίΤς÷–Θ§ΖΔ…ζΖ¥”Π3AΘ®gΘ©+BΘ®gΘ©xCΘ®gΘ©+2DΘ®gΘ©Θ°Ψ≠5minΚσ¥οΒΫΤΫΚβΘ§ΤΫΚβ ±≤βΒΟDΒΡ≈®Ε»ΈΣ0.5mol/LΘ§cΘ®AΘ©ΘΚcΘ®BΘ©=3ΘΚ5Θ§vΘ®CΘ©=0.1mol/Θ®LminΘ©Θ°‘ρΘΚ
Θ®1Θ©x= Θ°
Θ®2Θ©«Α5minΡΎBΒΡΖ¥”ΠΥΌ¬ vΘ®BΘ©= Θ°
Θ®3Θ©ΤΫΚβ ±AΒΡΉΣΜ·¬ ΈΣ Θ°
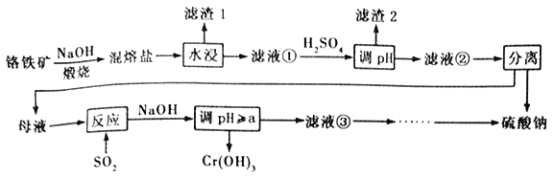
Θ®4Θ©IIΘ°Υ°’τΤχΆ®Ιΐ÷Υ»»ΒΡΧΦ≤ψΖΔ…ζΖ¥”ΠΘΚCΘ®sΘ©+H2OΘ®gΘ©COΘ®gΘ©+H2Θ®gΘ©ΓςHΘ° “―÷ΣΘΚKΘ®300ΓφΘ©ΘΦKΘ®350ΓφΘ©Θ§‘ρΗΟΖ¥”Π «»»Ζ¥”ΠΘ°
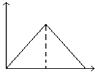
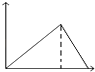
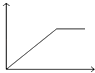
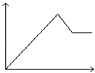
Θ®5Θ©…œ ωΖ¥”Π‘Ύt0 ±ΩΧ¥οΒΫΤΫΚβΘ§‘Ύt1 ±ΩΧΗΡ±δΡ≥“ΜΧθΦΰΚσ’ΐΖ¥”ΠΥΌ¬ Θ®ΠΆ’ΐΘ©Υφ ±ΦδΒΡ±δΜ·»γœ¬ΆΦΥυ ΨΘ§Χν≥ωΕ‘”ΠΒΡ±ύΚ≈Θ° 
ΔΌΥθ–Γ»ίΤςΧεΜΐΘΜ ΔΎΫΒΒΆΈ¬Ε»
Θ®6Θ©“―÷ΣΖ¥”ΠΔΌCOΘ®gΘ©+CuOΘ®gΘ©CO2Θ®gΘ©+CuΘ®sΘ©ΔΎH2Θ®gΘ©+CuOΘ®gΘ©CuΘ®sΘ©+H2OΘ®gΘ© ‘ΎœύΆ§ΒΡΡ≥Έ¬Ε»œ¬ΒΡΤΫΚβ≥Θ ΐΖ÷±πΈΣK1ΚΆK2 Θ§ ΗΟΈ¬Ε»œ¬Ζ¥”ΠCOΘ®gΘ©+H2OΘ®gΘ©CO2Θ®gΘ©+H2Θ®gΘ©ΒΡΤΫΚβ≥Θ ΐK=Θ®”ΟK1ΚΆK2±μ ΨΘ©Θ°
ΓΨ¥πΑΗΓΩ
Θ®1Θ©2
Θ®2Θ©0.05mol/Θ®L?minΘ©
Θ®3Θ©50%
Θ®4Θ©Έϋ
Θ®5Θ©bΘΜ f
Θ®6Θ©![]()
ΓΨΫβΈωΓΩΫβΘΚIΘ°DΒΡ≈®Ε»ΈΣ0.5mol/LΘ§Υυ“‘DΒΡΈο÷ ΒΡΝΩΈΣ1molΘ°CΈο÷ ΒΡΝΩ=0.1mol/Θ®LminΘ©ΓΝ2LΓΝ5min=1molΘ§
…ηAΓΔBΒΡΈο÷ ΒΡΝΩΈΣnmolΘ§
3AΘ®gΘ©+ | BΘ®gΘ©= | xCΘ®gΘ©+ | 2DΘ®gΘ© | |
Τπ Φ | n mol | n mol | 0 | 0 |
ΉΣΜ· | 1.5mo | 0.5mol | 1mol | 1mol |
5min | Θ®n©¹1.5Θ©mol | Θ® n©¹0.5Θ©mol | 1mol | 1mol |
Ά§“Μ»ίΤς÷–Θ§cΘ®AΘ©ΘΚcΘ®BΘ©=nΘ®AΘ©ΘΚnΘ®BΘ©= ![]() =
= ![]() ΘΜn=3molΘ§Θ®1Θ©CΒΡΖ¥”ΠΥΌ¬ «0.1mol/Θ®LminΘ©Θ§CΈο÷ ΒΡΝΩ=0.1mol/Θ®LminΘ©ΓΝ2LΓΝ5min=1molΘ§
ΘΜn=3molΘ§Θ®1Θ©CΒΡΖ¥”ΠΥΌ¬ «0.1mol/Θ®LminΘ©Θ§CΈο÷ ΒΡΝΩ=0.1mol/Θ®LminΘ©ΓΝ2LΓΝ5min=1molΘ§ ![]() =1Θ§Υυ“‘x=2Θ§
=1Θ§Υυ“‘x=2Θ§
Ι ¥πΑΗΈΣΘΚ2ΘΜΘ®2Θ©CΒΡΖ¥”ΠΥΌ¬ «0.1mol/Θ®LminΘ©Θ§ΗυΨίΆ§“ΜΖ¥”Π÷–Θ§ΗςΈο÷ ΒΡΖ¥”ΠΥΌ¬ ÷°±»Β»”ΎΦΤΝΩ ΐ÷°±»Θ§Υυ“‘BΒΡΖ¥”ΠΥΌ¬ « ![]() ΓΝ0.1mol/Θ®LminΘ©=0.05mol/Θ®LminΘ©Θ§
ΓΝ0.1mol/Θ®LminΘ©=0.05mol/Θ®LminΘ©Θ§
Ι ¥πΑΗΈΣΘΚ0.05mol/Θ®LminΘ©ΘΜΘ®3Θ©AΒΡΉΣΜ·¬ ΈΣΘΚ ![]() ΓΝ100%=50%Θ§Ι ¥πΑΗΈΣΘΚ50%ΘΜ
ΓΝ100%=50%Θ§Ι ¥πΑΗΈΣΘΚ50%ΘΜ
ΔρΘ°Θ®4Θ©“―÷ΣΘΚKΘ®300ΓφΘ©ΘΦKΘ®350ΓφΘ©Θ§ΥφΈ¬Ε»…ΐΗΏΤΫΚβ≥Θ ΐ‘ω¥σΘ§ΥΒΟςΤΫΚβ’ΐœρΫχ––Θ§’ΐΖ¥”ΠΈΣΈϋ»»Ζ¥”ΠΘ§Ι ¥πΑΗΈΣΘΚΈϋΘΜ Θ®5Θ©ΔΌΥθ–Γ»ίΤςΧεΜΐΘ§―Ι«Ω‘ω¥σΘ§Υ≤Φδ’ΐΡφΖ¥”ΠΥΌ¬ ΕΦ‘ω¥σΘ§ΤΫΨυœρΡφΖ¥”ΠΖΫœρ“ΤΕ·Θ§ΡφΖ¥”ΠΥΌ¬ ‘ω¥σΗϋΕύΘ§ΥφΚσ’ΐΖ¥”ΠΥΌ¬ ‘ω¥σΒΫ–¬ΤΫΚβΘ§Ι «ζœΏbΖϊΚœΘ§
Ι ¥πΑΗΈΣΘΚbΘΜ
ΔΎΫΒΒΆΈ¬Ε»Θ§Υ≤Φδ’ΐΡφΖ¥”ΠΥΌ¬ ΕΦΦθ–ΓΘ§ΤΫΨυœρΡφΖ¥”ΠΖΫœρ“ΤΕ·Θ§’ΐΖ¥”ΠΥΌ¬ Φθ–ΓΗϋΕύΘ§ΥφΚσ’ΐΖ¥”ΠΥΌ¬ ‘ω¥σΒΫ–¬ΤΫΚβΘ§ΒΫ¥ο–¬ΤΫΚβ ±ΒΡΥΌ¬ –Γ”Ύ‘≠ΤΫΚβΒΡΥΌ¬ Θ§«ζœΏfΖϊΚœΘ§Ι ¥πΑΗΈΣΘΚfΘΜΘ®6Θ©ΔΌCOΘ®gΘ©+CuOΘ®gΘ©CO2Θ®gΘ©+CuΘ®sΘ©ΔΎH2Θ®gΘ©+CuOΘ®gΘ©CuΘ®sΘ©+H2OΘ®gΘ©Θ§
Ζ¥”ΠΔΌΒΡΤΫΚβ≥Θ ΐK1= ![]() Θ§Ζ¥”ΠΔΎΒΡΤΫΚβ≥Θ ΐK2=
Θ§Ζ¥”ΠΔΎΒΡΤΫΚβ≥Θ ΐK2= ![]() Θ§Ζ¥”ΠΔέΘΚCOΘ®gΘ©+H2OΘ®gΘ©CO2Θ®gΘ©+H2Θ®gΘ©ΒΡΤΫΚβ≥Θ ΐΈΣK=
Θ§Ζ¥”ΠΔέΘΚCOΘ®gΘ©+H2OΘ®gΘ©CO2Θ®gΘ©+H2Θ®gΘ©ΒΡΤΫΚβ≥Θ ΐΈΣK= ![]() =
= ![]() Θ§
Θ§
Ι ¥πΑΗΈΣΘΚ ![]() Θ°
Θ°
ΔώΘ°œ»…ηAΓΔBΒΡΈο÷ ΒΡΝΩΈΣnmolΘΜΗυΨίDΒΡ≈®Ε»ΦΤΥψDΒΡΈο÷ ΒΡΝΩΘ§ΗυΨίDΒΡΈο÷ ΒΡΝΩΦΤΥψΖ¥”ΠΒΡAΓΔBΒΡΈο÷ ΒΡΝΩΘ§ΗυΨί5min ±Θ§AΓΔB≈®Ε»÷°±»«σ≥ωAΓΔBΩΣ Φ ±ΒΡΈο÷ ΒΡΝΩΘ§”ΟΩΣ Φ ±ΒΡΈο÷ ΒΡΝΩΦθΖ¥”ΠΒΡΈο÷ ΒΡΝΩΦ¥ΈΣ5minΡ©ΒΡΈο÷ ΒΡΝΩΘ§‘ΌΗυΨίΈο÷ ΒΡΝΩ≈®Ε»ΙΪ ΫΦΤΥψ≈®Ε»ΘΜΖ¥”ΠΥΌ¬ ÷°±»Φ¥ΈΣΦΤΝΩ ΐ÷°±»ΘΜΗυΨίCΒΡΖ¥”ΠΥΌ¬ «σAΒΡΖ¥”ΠΥΌ¬ Θ°ΗυΨίAΒΡΉΣΜ·≈®Ε»ΦΤΥψAΒΡΉΣΜ·¬ ΘΜ
ΔρΘ°Θ®4Θ©Έ¬Ε»‘ΫΗΏΤΫΚβ≥Θ ΐ‘Ϋ¥σΥΒΟς…ΐΈ¬ΤΫΚβ’ΐœρΫχ––ΘΜΘ®5Θ©ΔΌΥθ–Γ»ίΤςΧεΜΐΘ§―Ι«Ω‘ω¥σΘ§Υ≤Φδ’ΐΡφΖ¥”ΠΥΌ¬ ΕΦ‘ω¥σΘ§ΤΫΨυœρΡφΖ¥”ΠΖΫœρ“ΤΕ·Θ§ΡφΖ¥”ΠΥΌ¬ ‘ω¥σΗϋΕύΘ§ΥφΚσ’ΐΖ¥”ΠΥΌ¬ ‘ω¥σΒΫ–¬ΤΫΚβΘΜ
ΔΎΫΒΒΆΈ¬Ε»Θ§Υ≤Φδ’ΐΡφΖ¥”ΠΥΌ¬ ΕΦΦθ–ΓΘ§ΤΫΨυœρΡφΖ¥”ΠΖΫœρ“ΤΕ·Θ§’ΐΖ¥”ΠΥΌ¬ Φθ–ΓΗϋΕύΘ§ΥφΚσ’ΐΖ¥”ΠΥΌ¬ ‘ω¥σΒΫ–¬ΤΫΚβΘ§ΒΫ¥ο–¬ΤΫΚβ ±ΒΡΥΌ¬ –Γ”Ύ‘≠ΤΫΚβΒΡΥΌ¬ ΘΜΘ®6Θ©”…ΖΫ≥Χ ΫΩ…÷ΣΘ§Ζ¥”ΠΔέ=Ζ¥”ΠΔΌ©¹Ζ¥”ΠΔΎΘ§ΗυΨίΜ·―ßΤΫΚβ≥Θ ΐ±μ¥ο ΫΘ§Ϋχ––ΆΤΒΦ≈–ΕœΘ°

ΓΨΧβΡΩΓΩ“―÷Σ25Γφ ±Θ§ΦΗ÷÷≥ΘΦϊ»θΒγΫβ÷ ΒΡΒγάκΤΫΚβ≥Θ ΐ»γœ¬±μΥυ Ψ:
ΒγΫβ÷ | H3PO4 | NH3ΓΛH2O | C6H5OH |
ΒγάκΤΫΚβ≥Θ ΐ | K1=7.5ΓΝ10-3 K2=7.5ΓΝ10-8 K3=7.5ΓΝ10-13 | 1.7ΓΝ10-5 | 1.1ΓΝ10-10 |
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. NaH2PO4»ή“Κ≥ Φν–‘
B. 25Γφ ±Θ§0.1moL/LΑ±Υ°ΒΡpH=11+lg1.7
C. ΉψΝΩC6H5OH”κNa3PO4Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ:2C6H5OH+PO43-=H2PO4-+2C6H5O-
D. 25Γφ ±Θ§ΫΪΒ»ΧεΜΐΒ»≈®Ε»ΒΡ±ΫΖ”»ή“Κ”κΑ±Υ°ΜλΚœΘ§ΜλΚœ»ή“Κ÷–ΗςάκΉ”≈®Ε»ΙΊœΒΘΚc(C6H5O-)>c(NH4+)>c(OH-)>c(H+)