题目内容
6.在下列各溶液中,离子一定能大量共存的是( )| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| C. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ | |
| D. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
分析 A.铝离子与强碱性溶液中的氢氧根离子反应;
B.水电离出来的c(H+)=10-13mol/L的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子能够与氢离子和氢氧根离子反应;
C.碳酸根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
D.pH=1的溶液中含有大量氢离子,四种离子之间不反应,都不与氢离子反应.
解答 解:A.Al3+与强碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.水电离出来的c(H+)=10-13mol/L的溶液为酸性或碱性溶液,HCO3-能够与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.CO32-、Al3+之间是双水解反应,在溶液中不能大量共存,故C错误;
D.室温下pH=1的溶液为酸性溶液,Na+、Fe3+、NO3-、SO42-离子之间不反应,都不与酸性溶液反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
16.某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
回答下列问题:
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)附表:溶解度表
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| NaCO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)附表:溶解度表
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
1.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得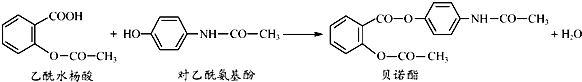
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| C. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
11.下列热化学方程式书写正确的是( )
| A. | 2SO2+O2?2SO3 △H=-196.6kJ/mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═2H2O(l)△H=-285.8kJ/mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6kJ•mol-1 | |
| D. | C(s)+O2(g)═CO2(g)△H=+395.9kJ/mol-1 |
18.下列装置所示的实验不能达到目的是( )
| A. | 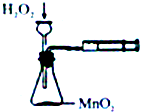 定量测定化学反应速率 | B. | 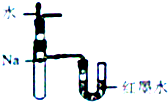 验证Na和水反应的热效应 | ||
| C. |  比较KMnO4、cl2、S的氧化性 | D. | 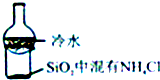 加热烧杯,分离SiO2和NH4Cl |
13.下列各组化合物的水溶液中,碱的碱性减弱,酸的酸性增强的是( )
| A. | NaOH,LiOH,HNO3,H3PO4 | B. | Mg(OH)2,Al(OH)3,HBrO4,HClO4 | ||
| C. | Mg(OH)2,Ca(OH)2,H3PO4,H2SO4 | D. | NaOH,Mg(OH)2,H3PO4,HClO4 |
 和
和 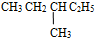 ⑤
⑤ 和
和
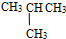 ⑦C2H5OH和C4H9OH
⑦C2H5OH和C4H9OH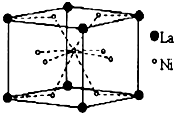 储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.
储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.