题目内容
16.某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| NaCO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)附表:溶解度表
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
分析 (1)碳酸氢钠溶液中,碳酸氢根离子部分水解,溶液呈碱性;
(2)10mL水的质量约为10g,结合表中20℃时碳酸钠、碳酸氢钠的溶解度进行判断;
(3)根据碳酸钠、碳酸氢钠溶解后表中温度T1与室温大小进行判断;
(4)10mL 20%的盐酸(20℃)溶于水是放热还是吸热,影响碳酸钠、碳酸氢钠与盐酸反应的能量变化;
(5)A.相同浓度和体积的盐酸溶于水后温度为22.2℃,而NaHCO3与盐酸的反应后温度变为20.8℃,反应后温度降低说明碳酸氢钠与盐酸的反应是吸热反应;
B.碳酸钠、碳酸氢钠分别与相同浓度的盐酸反应的现象不同,可以用盐酸鉴别碳酸钠和碳酸氢钠;
C.根据实验可知,Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关;
(6)A.此方案利用碳酸氢钠的不稳定性,利用差量法即可计算质量分数;
B.根据钠守恒,可列方程组求解;
C.应先把水蒸气排除才合理;
D.根据质量关系,可列方程组求解;
碳酸钠性质稳定,加热不分解,碳酸氢钠热稳定性较差,加热分解导致固体质量减少,根据固体质量变化利用差量法可以计算出混合物中碳酸氢钠的质量,再计算出碳酸氢钠的质量及质量分数即可.
解答 解:(1)碳酸氢钠溶液中,碳酸氢根离子部分水解:HCO3-+H2O?H2CO3+OH-,导致溶液呈碱性,
故答案为:碱;HCO3-+H2O?H2CO3+OH-;
(2)20℃时碳酸钠的溶解度为21.5g,碳酸氢钠的溶解度为9.6g,则分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),10mL水的质量约为10g,在该温度下最多能够溶解2.15g碳酸钠、0.96g碳酸钠,所以碳酸钠和碳酸氢钠都能够完全溶解,
故答案为:是;
(3)根据表中数据可知,碳酸钠溶解后溶液温度升高,说明碳酸钠溶于水放热;碳酸氢钠溶解后溶液温度降低,说明碳酸氢钠溶于水吸热,
故答案为:放热;吸热;
(4)10mL 密度约为1.1g/mL 20%的盐酸(20℃)溶于水的反应热会影响碳酸钠、碳酸氢钠与盐酸反应的能量变化,所以需要补充实验:向盛有10mL水(20℃)的烧杯中加入10mL 密度约为1.1 g/mL 20%的盐酸(20℃),分析温度变化,
故答案为:密度约为1.1 g/mL 20%的盐酸(20℃);
(5)A.同样浓度的盐酸溶于水后温度为22.2℃,而NaHCO3与盐酸的反应后温度变为 20.8℃,说明碳酸氢钠与盐酸的反应是吸热反应,故A正确;
B.碳酸钠与盐酸先反应生成碳酸氢钠,然后碳酸氢钠再与盐酸反应生成二氧化碳气体,而碳酸氢钠中加入盐酸后立刻生成二氧化碳,可用稀盐酸鉴别Na2CO3和NaHCO3固体,故B错误;
C.根据实验可知,Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关,不能直接根据反应温度判断,故C正确;
故答案为:AC;
(6)A.NaHCO3受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出Na2CO3质量分数,故A错误;
B.Na2CO3和NaHCO3均可与盐酸反应生成水、二氧化碳和氯化钠,所以bg固体是氯化钠,利用守恒法可计算出Na2CO3质量分数,故B错误;
C.混合物与足量稀硫酸充分反应,也会生成水和二氧化,所以逸出的气体是二氧化碳,但会混有水蒸气,即碱石灰增加的质量不是二氧化碳的质量,不能测定含量,故C正确;
D.Na2CO3和NaHCO3都与Ba(OH)2反应,反应的方程式为CO32-+Ba2+=BaCO3↓、HCO3-+OH-+Ba2+=H2O+BaCO3↓,因此最后得到的固体是BaCO3,所以可以计算出Na2CO3质量分数,故D错误;
加热过程中碳酸钠不变,碳酸氢钠分解,反应的方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
反应前后固体质量变化为:bg,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ 减少的固体质量△m
168 106 62
m(NaHCO3) bg
则:m(NaHCO3)=$\frac{168×bg}{62}$=$\frac{84}{31}$bg,
所以该样品中碳酸氢钠的质量分数为:$\frac{\frac{84}{31}bg}{ag}$×100%=$\frac{84b}{31a}$×100%,
故答案为:C; $\frac{84b}{31a}$×100%.
点评 该题以碳酸钠与碳酸氢钠的性质比较为载体,侧重于化学实验方案的评价,题目难度中等,注意把握碳酸钠、碳酸氢钠的性质以及实验方案的原理.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 四氯化碳的电子式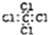 | B. | C2H4的球棍模型 | ||
| C. | 环已烷的结构简式 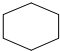 | D. | 次氯酸的结构式:H-Cl-O |
| 序号 | 物质 | 试剂 | 分离方法 |
| ① | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ② | 溴苯(溴) | NaOH溶液 | 分液 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(环己烷) | 水 | 分液 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ④③ |
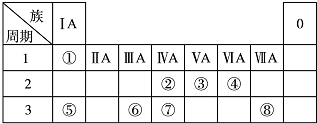
(1)地壳中含量居于第二位的元素在周期表中的位置是第三周期第ⅣA族.
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式
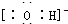 .
.(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能作该反应催化剂的是(填序号)bc.
a.MnO2 b.HI c.Na2SO3 d.FeCl3
(4)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | ||
| 2 |
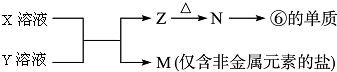
X溶液与Y溶液反应的离子方程式Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,M中阳离子的鉴定方法取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
| A. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I的核外电子数不同 | |
| B. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I的中子数分别为74和78 | |
| C. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I属不同种元素 | |
| D. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I是同一种核素 |
| A. | CH3COO-、H+、Na+、K+ | B. | NH4+、OH-、Ba2+、Cl- | ||
| C. | Ca2+、NO3-、Ba2+、K+ | D. | NO3-、Ba2+、H+、Fe2+ |
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
(2)能与溴水反应使之褪色的烃是(填序号):③.
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为nCH2=CH2$\stackrel{催化剂}{→}$

(4)能使酸性高锰酸钾褪色的烃是(填结构简)CH2=CH2、
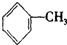 、
、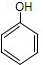 .
.(4)彼此互为同系物的是(填序号):④⑤.
(5)甲苯的一氯取代产物的有4种,请写出甲苯的一氯取代产物结构简式:
 .
. | A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| C. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ | |
| D. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
